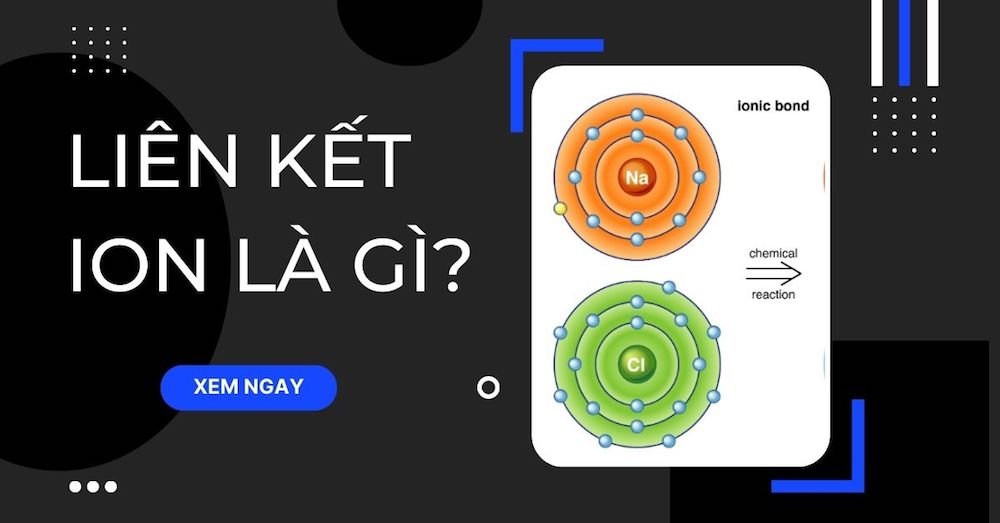
Trong chương trình Hóa học 10, bên cạnh Liên kết cộng hóa trị, Liên kết ion cũng là một loại cần lưu ý khi học. Bài viết này congthuctoanlyhoa sẽ chia sẻ về lý thuyết và bài tập của dạng liên kết ion này.
Sự tạo thành liên kết ion, anion, cation
Ion (điện tích) là quá trình một nhóm nguyên tử hay nguyên tử tử bị mất hoặc nhận thêm một hay nhiều electron.
ion âm (anion)
Ion mang điện tích âm gọi là ion âm hay anion.
Nếu các nguyên tử nhận thêm electron khi tham gia phản ứng hóa học nó sẽ trở thành các phần tử mang điện tích âm hay còn gọi là anion.
Ví dụ: Nguyên tử F (Z = 9)
Cấu hình e: 1s22s22p5
1s22s22p5 + 1e → 1s22s22p6
(F) (F–)
Hay: F + 1e → F–
F–gọi là anion florua.
ion dương (cation)
Ion mang điện tích dương gọi là ion dương hay cation.
Nếu các nguyên tử nhường bớt electron khi tham gia phản ứng hóa học nó sẽ trở thành các phần tử mang điện tích dương hay còn gọi là cation.
Ví dụ: Nguyên tử Li (Z = 3)
Cấu hình e: 1s22s1
1s22s1 → 1s2 + 1e
(Li) (Li+)
Hay: Li → Li+ + 1e
Li+ gọi là cation liti.
Ion đơn nguyên tử và đa nguyên tử
- Ion đơn nguyên tử là ion tạo nên từ 1 nguyên tử. Ví dụ cation Li+, Na+, Mg2+, Al3+và anion F –, Cl–, S2-, …
- Ion đa nguyên tử là những nhóm nguyên tử mang điện tích dương hay âm . Ví dụ: cation amoni NH4+, anion hidroxit OH–, anion sunfat SO42–, …
Liên kết ion được hình thành như thế nào?
Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Ví dụ: Na+ + Cl– → NaCl
⇒ Liên kết giữa cation Na+ và anion Cl– là liên kết ion.
Điều kiện
Liên kết ion chỉ được hình thành khi có 2 điều kiện sau:
-
Liên kết được hình thành bởi các nguyên tố có tính chất khác hẳn nhau (giữa kim loại và phi kim).
-
Trừ một số trường hợp điển hình, hiệu độ âm điện giữa 2 nguyên tử liên kết ion phải >= 1,7.
Dấu hiệu nhận biết
-
Phân tử hợp chất được hình thành từ kim loại điện hình đến phi kim điển hình. Ví dụ: NaCl, CaCl2, BaF2,… Các hợp chất này đều chứa liên kết ion- liên kết được hình thành giữa anion phi kim và anion kim loại.
-
Phân tử chứa hợp chất muối và cation hoặc anion đa nguyên tử.
Ví dụ: MgSO4, NH4Cl,… Đây đều là liên kết ion – liên kết này được hình thành giữa anion phi kim và cation kim loại và anion gốc axit.
So sánh giữa liên kết ion và liên kết cộng hóa trị
Trong chương trình Hóa học 10, ta đã làm quen qua liên kết cộng hóa trị ở bài trước. Đây là bảng so sánh giữa cộng hóa trị và ion là như thế nào:
| Loại liên kết | Liên kết ion | Liên kết cộng hoá trị | |
| Không cực | Có cực | ||
| Định nghĩa | Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu | Liên kết cộng hoá trị là liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung | |
| Bản chất liên kết | Electron chuyển từ nguyên tử này sang nguyên tử kia | Đôi electron chung không lệch về phía nguyên tử nào | Đôi electron chung lệch về nguyên tử nào có độ âm điện lớn hơn. |
| Hiệu độ âm điện Δχ | Δχ ≥ 1,7 | 0 ≤ Δχ < 0,4 | 0,4 ≤ Δχ < 1,7 |
| Đặc tính | Bền | Bền | |
Tính chất của hợp chất có liên kết ion
-
Trạng thái: Chất rắn ion tồn tại ở nhiệt độ phòng và ở dạng tinh thể.
-
Cấu trúc: Thông thường ion được sắp xếp theo cấu trúc mạng tinh thể.
-
Tính dẫn điện: Ở tinh thể rắn, ion không dẫn điện, nhưng ở dạng dung dịch thì dẫn điện.
-
Dễ vỡ khi gặp áp lực: Khi bị đặt dưới áp lực, các hợp chất của ion dễ vỡ đồng thời liên kết bị phá vỡ dọc theo các mặt phẳng.
-
Lực hút tĩnh điện: Liên kết ion là liên kết có lực hút tĩnh điện mạnh. Do đó, hợp chất ion thường được biết đến là rất cứng, nhiệt độ nóng chảy và nhiệt độ sôi cao do liên kết ion tương đối bền vững. Ví dụ: NaCl có nhiệt độ nóng chảy là 800 độ, MgO là 2800 độ.
-
Dẫn điện: Ở trạng thái nóng chảy và khi tan trong dung dịch. Ở trạng thái rắn thường không dẫn điện.
Bài tập minh họa về liên kết ion
Bài 1 (trang 59 SGK Hóa 10):
Liên kết hóa học trong NaCl được hình thành là do:
A. Hai hạt nhân nguyên tử hút electron rất mạnh.
B. Mỗi nguyên tử Na và Cl góp chung 1 electron.
C. Mỗi nguyên tử đó nhường hoặc thu electron để trở thành các ion trái dấu hút nhau.
D. Na → Na+ e ; Cl + e → Cl- ; Na+ + Cl- → NaCl.
Chọn đáp án đúng nhất
Đáp án: D
Bài 2 (trang 59 SGK Hóa 10):
Muối ăn ở thể rắn là:
A. Các phân tử NaCl
B. Các ion Na+ và Cl-
C. Các tinh thể hình lập phương: các ion Na+ và Cl- được phân bố luân phiên đều đặn trên mỗi đỉnh.
D. Các tinh thể hình lập phương: các ion Na+ và Cl- được phân bố luân phiên đều đặn thành từng phân tử riêng rẽ.
Chọn đáp án đúng nhất.
Đáp án: C
Bài 3 (trang 60 SGK Hóa 10):
a) Viết cấu hình electron của cation liti (Li+) và anion oxit (O2-).
b) Những điện tích ở ion Li+ và O2- do đâu mà có?
c) Nguyên tử khí hiếm nào có cấu hình electron giống Li+ và nguyên tử khí hiếm nào có cấu hình electron giống O2-.
d) Vì sao 1 nguyên tử oxi kết hợp được với 2 nguyên tử liti?
Đáp án:
a) Cấu hình electron của cation liti (Li+) là 1s2 và anion oxit (O2-) là 1s22s22p6.
b) Điện tích ở Li+ do mất 1e mà có, điện tích ở O2- do O nhận thêm 2e mà có.
c) Nguyên tử khí hiếm He có cấu hình electron giống Li+
Nguyên tử khí hiếm Ne có cấu hình electron giống O2-
d) Vì mỗi nguyên tử liti chỉ có thể nhường 1e, mà một nguyên tử oxi thu 2e.
2Li → 2Li+ + 2e;
O + 2e → O2-;
2Li+ + O2- → Li2O.
Tổng kết
Bài viết về Liên kết ion từ congthuctoanlyhoa đến đây là kết thúc. Hy vọng nó sẽ giúp các bạn nắm được kiến thức cơ bản về liên kết này cũng như có sự phân biệt rõ ràng với liên kết cộng hóa trị.