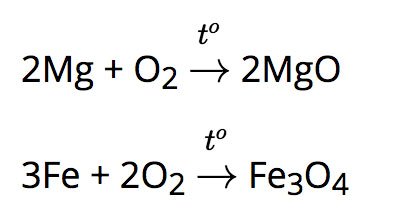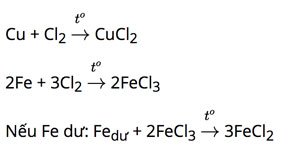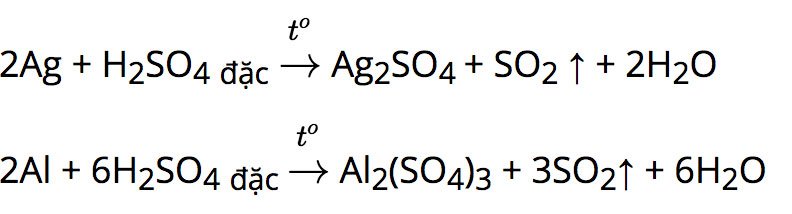Cùng congthuctoanlyhoa khám phá Lý thuyết Tính chất hóa học của kim loại chi tiết, đầy đủ nhất. Bài viết cung cấp cho các em cái nhìn sâu sắc về Tính chất hoá học của kim loại và cách giải các bài tập. Bài viết này sẽ hỗ trợ cho các em trong việc học tốt môn Hoá học lớp 9.

I. Lý thuyết Tính chất hóa học của kim loại
1. Tác dụng với phi kim
a) Tác dụng với oxi:
Hầu hết kim loại (trừ Au, Pt, Ag,..) tác dụng với oxi ở nhiệt độ thường hoặc nhiệt độ cao, tạo thành oxit.
Ví dụ:
b) Tác dụng với phi kim khác (Cl2, S, …):
Nhiều kim loại tác dụng với nhiều phi kim, tạo thành muối.
– Tác dụng với Cl2: tạo muối clorua (kim loại có hóa trị cao nhất)
Ví dụ:
– Tác dụng với lưu huỳnh: khi đun nóng tạo muối sunfua (trừ Hg xảy ra ở nhiệt độ thường)
Hg + S → HgS
=> Ứng dụng: dùng lưu huỳnh để thu hồi thủy ngân khi ống nhiệt kế bị vỡ
2. Tác dụng với dung dịch axit
a. Tác dụng với dung dịch HCl và H2SO4 loãng
– Nhiều kim loại (trừ Cu, Ag, Au, Pt) tác dụng với dung dịch axit (HCl, H2SO4 loãng…) tạo thành muối và H2
Ví dụ:
Fe + 2HCl → FeCl2 + H2
2Al + 3H2SO4 (loãng) → Al2(SO4)3 + 3H2
b. Tác dụng với axit H2SO4 đặc nóng và HNO3 đặc nóng
3. Tác dụng với dung dịch muối
Kim loại hoạt động mạnh hơn (trừ các kim loại phản ứng với nước như Na, K, Ba, Ca…) tác dụng với muối của kim loại yếu hơn, tạo thành muối mới và kim loại mới.
Ví dụ:
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Nhận xét: Cu hoạt động hóa học mạnh hơn Ag
Fe + CuSO4 → FeSO4 + Cu
Nhận xét: Fe hoạt động hóa học mạnh hơn Cu
=> Hoạt động hóa học của Fe > Cu > Ag
III. Giải bài tập SGK Tính chất hóa học của kim loại
Bài 1 Trang 51 SGK hóa 9
Kim loại có những tính chất hoá học nào? Lấy thí dụ và viết các phương trình hoá học minh hoạ với kim loại magie.
Hướng dẫn giải bài tập
- Phản ứng của kim loại với phi kim:
2Cu + O2 → 2CuO
Mg + Cl2 → MgCl2
- Phản ứng của kim loại với dung dịch axit:
Fe + 2HCl → FeCl2 + H2 ↑
Fe + H2SO4loãng → FeSO4 + H2 ↑
- Phản ứng của kim loại với dung dịch muối:
Mg + CuSO4 → MgSO4 + Cu
Bài 2 Trang 51 SGK hóa 9
Hãy viết các phương trình hoá học theo các sơ đồ phản ứng sau đây:
a) ………. + HCl → MgCl2 + H2;
b) ……… + AgNO3 → Cu(NO3)2 + Ag;
c) ……… + ………… → ZnO;
d) …….. + Cl2 → CuCl2
e) ……. + S → K2S.
Hướng dẫn giải bài tập
Hãy viết các phương trình hoá học theo các sơ đồ phản ứng sau đây:
a) Mg + 2HCl → MgCl2 + H2↑;
b) Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓;
c) 2Zn + O2 → 2ZnO;
d) Cu + Cl2 → CuCl2
e) 2K + S → K2S
Bài 3 Trang 51 SGK hóa 9
Viết các phương trình hoá học của các phản ứng xảy ra giữa các cặp chất sau đây:
a) Kẽm + Axit sunturic loãng;
b) Kẽm + Dung dịch bạc nitrat;
c) Natri + Lưu huỳnh;
d) Canxi + Clo.
Hướng dẫn giải bài tập
a) Zn + H2SO4 → ZnSO4 + H2↑
b) Zn + 2AgNO3 → Zn(NO3)2 + 2Ag↓
c) 2Na + S → Na2S
d) Ca + Cl2 → CaCl2
Bài 4 Trang 51 SGK hóa 9
Dự đoán hiện tượng và viết phương trình hoá học khi:
a) Đốt dây sắt trong khí clo.
b) Cho một đinh sắt vào ống nghiệm đựng dung dịch CuCl2.
c) Cho một viên kẽm vào dung dịch CuSO4.
Hướng dẫn giải bài tập
a) Khói màu nâu đỏ tạo thành: 2Fe + 3Cl2 → 2FeCl3
b) Dung dịch CuCl2 →FeCl2 + Cu↓
c) Dung dịch CuSO4 nhạt màu, kim loại màu đỏ bám ngoài viên kẽm:
Zn + CuSO4 → ZnSO4 + Cu↓
Bài 5 Trang 51 SGK hóa 9
Ngâm một lá kẽm trong 20g dung dịch muối đồng sunfat 10% cho đến khi kẽm không tan được nữa. Tính khối lượng kẽm đã phản ứng với dung dịch trên và nồng độ phần trăm của dung dịch sau phản ứng.
Hướng dẫn giải bài tập
Ta có: mCuSO4 = 20.0,1 = 2(g)
=> nCuSO4 = 0,0125 (mol)
PTHH: Zn + CuSO4 → ZnSO4 + Cu↓
1 mol 1 mol 1 mol
0,0125 mol 0,0125 mol 0,0125 mol
=> mZn = n.M = 0,0125. 65 = 0,81 (g)
mZnSO4 = n.M = 0,0125. 161= 2,01 (g)
mdd sau pư = mddCuSO4 + mZn – mCu giải phóng
Nồng độ % dung dịch ZnSO4 là: C% = (2,01/20).100% = 10,05 (%)
Vậy là các em đã tìm hiểu xong bài học về Lý thuyết Tính chất hóa học của kim loại. Mong các em sẽ học ngày càng tốt hơn nữa môn Hoá học 9.