Phi kim là gì?
Định nghĩa:
Phi kim được hiểu là những nguyên tố hóa học nhận e. Chúng sẽ nằm ở phía bên phải bảng tuần hoàn hóa học. Khi tham gia vào phản ứng hóa học, phim kim sẽ có xu hướng nhận electron nên thường mang điện tích âm. Ngược lại kim loại sẽ bị mất electron nên mang điện tích dương. Đa số các phi kim đều không dẫn điện, một số nguyên tố có sự biến tính (ví dụ như cacbon)
Phi kim bao gồm:
- Các loại khí hiếm: He, Ne, Ar, Rn,…
- Các halogen: Cl, F, Br, I, At
- Các phi kim còn lại: O, S, N, P, Se…
- Một số á kim như: Si, Bo…
Tính chất của phi kim
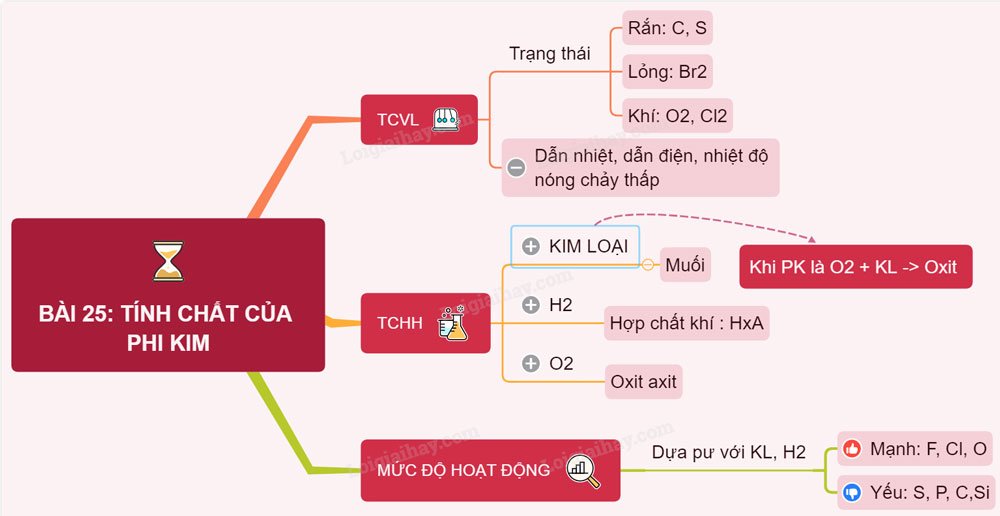
Tính chất vật lý
Hầu hết các phi kim đều không có khả năng dẫn điện.
Ở điều kiện thường, các phi kim có thể tồn tại ở dạng rắn, lỏng, khí.
- C, S, P… là những phi kim tiêu biểu tồn tại ở trạng thái rắn.
- Br tồn tại ở trạng thái lỏng,
- Các phi kim như Cl2, O2, H2… tồn tại ở trạng thái khí.
Các phi kim đều có nhiệt độ nóng chảy thấp.
Một số phi kim có thể chứa độc tố như clo hay brom.
Tính chất hóa học
Phi kim tác dụng với hidro
Phi kim có khả năng tác dụng với hidro tạo thành hợp chất khí.
-
Oxi tác dụng với hidro
Khí oxi tác dụng với khí hidro tạo thành hơi nước. Ta có phương trình hóa học:
O2 (k) + 2H2 (k) → 2H2O (h) (điều kiện nhiệt độ)
-
Clo tác dụng với khí hidro: H2 + Cl2 —-> 2HCl
- Ngoài clo, nhiều phi kim khác như cacbon (C), Lưu huỳnh (S), Brom (Br2),… có thể phản ứng với khí hidro tạo thành các hợp chất khí tương ứng.
Thực hiện thí nghiệm để chứng minh clo tác dụng với khí hidro bằng cách đưa hidro đang cháy vào lọ đựng khí clo. Sau phản ứng, cho một ít nước vào trong lọ rồi lắc nhẹ. Quan sát hiện tượng ta thấy khí hidro cháy trong khí clo tạo thành khí không màu, Màu vàng lục của khí clo ban đầu bị biến mất và dùng giấy quỳ tím thử xuất hiện màu đỏ. Như vậy, ta có thể kết luận được rằng khí clo đã phản ứng mạnh với khí hidro tạo thành khí hidro clorua không màu. Khí này sẽ tan trong nước tạo thành dung dịch axit clohidric (HCl) làm quỳ tím chuyển đỏ.
H2 (k) + Cl2 (k) → 2HCl (k) (điều kiện nhiệt độ)
Ngoài clo, nhiều phi kim khác như cacbon (C), Lưu huỳnh (S), Brom (Br2)… cũng có thể tác dụng với hidro tạo thành hợp chất khí.
Phi kim tác dụng với kim loại
Nhiều phi kim tác dụng với kim loại tạo thành muối hoặc oxit.
-
Nhiều phi kim tác dụng với kim loại tạo thành muối
Ví dụ:
Fe (rắn trắng xám) + S (rắn màu vàng) → FeS (rắn màu đen) (điều kiện nhiệt độ)
2 Na (r) + Cl2 (khí vàng lục) → 2NaCl (rắn màu trắng) (điều kiện nhiệt độ)
-
Oxi tác dụng với kim loại tạo thành oxit
Ví dụ:
4Fe (rắn trắng xám) + 3O2 (khí không màu) → 2Fe2O3 (rắn màu đỏ) (điều kiện nhiệt độ)
Phi kim tác dụng với phi kim khác
Thông thường, các phi kim sẽ tác dụng với oxit để tạo ra oxit axit.
S+O2→SO2
C+O2→CO2
Mức hoạt động hóa học của các phi kim
Mức hoạt động hóa học của phi kim sẽ được xác định dựa trên khả năng cũng như mức độ phản ứng của phi kim đó với hidro và đặc biệt là kim loại. Mức độ phản ứng với kim loại hay hidro càng mạnh thì phi kim đó hoạt động càng mạnh và ngược lại.
Dựa trên đặc điểm này, các nhà khoa học đã xác định được:
- Flo và Clo là những phi kim hoạt động rất mạnh. Hai chất này phản ứng rất nhanh và mạnh với hidro và kim loại, đặc biệt là Flo.
- C, S hay Si lại là những phi kim có mức độ phản ứng kém hơn. Do đó chúng có mức độ hoạt động kém hơn.
Các dạng toán liên quan đến phi kim
Trong chương trình Hóa học 9, có các dạng bài tập liên quan đến phi kim như sau:
Dạng 1: CO khử oxit kim loại
Lý thuyết
xCO + M2Ox → 2M + xCO2
Phương pháp giải
– Phương chung để giải là dùng phương pháp bảo toàn electron hoặc bảo toàn nguyên tố hoặc bảo toàn khối lượng, hoặc tang giảm khối lượng để giải.
Chú ý :
+ Trong các phản ứng của C, CO, H2 thì số mol CO= nCO2, nC= nCO2, nH2= nH2O.
+ Các chất khử C, CO, H2 không khử được các oxit MgO, Al2O3 và các oxit khác của kim loại kiềm và kiềm thổ.
+ Đa số khi giải chúng ta chỉ cần viết sơ đồ chung của phản ứng, chứ không cần viết PTHH cụ thể, tuy nhiên các phản ứng nhiệt nhôm nên viết rõ PTHH vì bài toán còn liên quan nhiều chất khác.
+ Thực chất khi cho CO, H2 tác dụng với các chất rắn là oxit thì khối lượng của chất rắn giảm đi chính là khối lượng của oxi trong các oxit.
Dạng 2: CO2 tác dụng với dung dịch kiềm
Lý thuyết và Phương pháp giải
1. Bài toán CO2, SO2 dẫn vào dung dịch NaOH, KOH
– Khi cho CO2 (hoặc SO2) tác dụng với dung dịch NaOH đều xảy ra 3 khả năng tạo muối:
CO2 + 2NaOH → Na2CO3 + H2O (1)
CO2 + NaOH → NaHCO3 (2)
Đặt T = nNaOH : nCO2
– Nếu T = 2 : chỉ tạo muối Na2CO3
– Nếu T ≤ 1: chỉ tạo muối NaHCO3
– Nếu 1 < T < 2 : tạo cả muối NaHCO3 và Na2CO3
* Có những bài toán không thể tính T. Khi đó phải dựa vào những dữ kiện phụ để tìm ra khả năng tạo muối.
– Hấp thụ CO2 vào NaOH dư ( KOH dư )chỉ tạo muối trung hòa Na2CO3 (K2CO3)
– Hấp thụ CO2 vào NaOH chỉ tạo muối Na2CO3, Sau đó thêm BaCl2 vào thấy kết tủa. Thêm tiếp Ba(OH)2 dư vào thấy xuất hiện thêm kết tủa nữa → Tạo cả 2 muối Na2CO3 và NaHCO3
– Chất hấp thụ vào bình NaOH tăng :
m bình tăng = m dd tăng = m chất hấp thụ ( CO2 + H2O có thể có )
– Trong trường hợp không có các dữ kiện trên thì chia trường hợp để giải.
2. Bài toán CO2, SO2 dẫn vào dung dịch Ca(OH)2, Ba(OH)2:
Do ta không biết sản phẩm thu được là muối nào nên phải tính tỉ lệ T:
Ca(OH)2 + CO2 → CaCO3↓ + H2O (1)
Ca(OH)2 + 2CO2 → Ca(HCO3)2 (2)
Đặt T = nCO2 : nCa(OH)2
– Nếu T ≤ 1: chỉ tạo muối CaCO3
– Nếu T = 2 : chỉ tạo muối Ca(HCO3)2
– Nếu 1 < T < 2: tạo cả muối CaCO3 và Ca(HCO3)2
– Hấp thụ CO2 vào nước vôi trong thấy có kết tủa, thêm NaOH dư vào thấy có kết tủa nữa suy ra có sự tạo cả CaCO3 và Ca(HCO3)2
– Hấp thụ CO2 vào nước vôi trong thấy có kết tủa, lọc bỏ kết tủa rồi đun nóng nước lọc lại thấy kết tủa nữa suy ra có sự tạo cả CaCO3 và Ca(HCO3)2.
– Nếu không có các dữ kiện trên ta phải chia trường hợp để giải.
* Khi những bài toán không thể tính T ta dựa vào những dữ kiện phụ để tìm ra khả năng tạo muối.
– Hấp thụ CO2 vào nước vôi dư thì chỉ tạo muối CaCO3.
* Sự tăng giảm khối lượng dung dịch : Khi cho sản phẩm cháy vào bình Ca(OH)2 hay Ba(OH)2.
m bình tăng = m hấp thụ
m dd tăng = m hấp thụ – m kết tủa
m dd giảm = m kết tủa – m hấp thụ
Tổng kết
Trên đây là toàn bộ lý thuyết cũng như các dạng bài tập và phương pháp giải có liên quan đến phi kim. Congthuctoanlyhoa.com hi vọng bạn có thể hiểu và áp dụng các kiến thức này vào trong học tập lẫn cuộc sống.