Oxit axit là gì? Oxit bazo là gì? Hai hợp chất này tính chất có hoàn toàn khác biệt nhau hay không? Bài viết tổng hợp toàn bộ lý thuyết về hai loại hợp chất oxit và cả những dạng bài tập liên quan.
Lý thuyết oxit axit
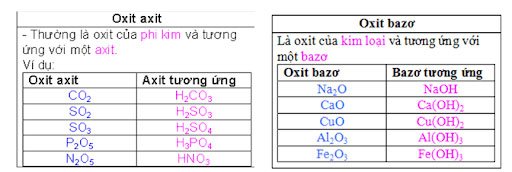
Định nghĩa
Đây là những oxit tác dụng với bazo để tạo ra muối và nước, phản ứng với nước tạo thành một axit.
Ví dụ: Mn2O7 – HMnO4, CO2 – H2CO3, P2O5 – H3PO4.
Tính chất hóa học
Tính tan: Đa số các oxit axit khi hoà tan vào nước sẽ tạo ra dung dịch axit trừ SiO2:
Na2O + H2SO4 → Na2SO4 + H2O
FeO + HCl → FeCl2 + H2O CuO + H2SO4 → CuSO4 + H2O
Tác dụng với oxit bazơ tan: Oxit axit tác dụng với oxit bazơ tan sẽ tạo muối:
SO3 + CaO -> CaSO4
P2O5 +3Na2O -> 2Na3PO4
Tác dụng với bazơ tan: Tuỳ vào tỉ lệ mol giữa oxit axit và bazơ phản ứng sẽ cho ra nước + muối trung hoà, muối axit hay hỗn hợp 2 muối:
- Gốc axit tương ứng có hoá trị II:
– Đối với kim loại trong bazơ có hoá trị I:
Tỉ lệ mol B: OA là 1:
NaOH +SO2 -> NaHSO3 (Phản ứng tạo muối axit)
Tỉ lệ mol B: OA là 2:
2KOH +SO3 -> K2SO3 +H2O (Phản ứng tạo muối trung hoà)
– Đối với kim loại trong bazơ có hoá trị II:
Tỉ lệ mol OA: B là 1:
CO2 +Ca(OH)2 ->CaCO3 (Phản ứng tạo muối trung hoà)
Tỉ lệ mol OA: B là 2:
SiO2 + Ba(OH)2 ->BaSiO3 (Phản ứng tạo muối axit)
- Đối với axit có gốc axit hoá trị III:
– Đối với kim loại có hoá trị I:
Tỉ lệ mol B: OA là 6:
P2O5 +6NaOH ->2Na2HPO4 +H2O
Tỉ lệ mol B: OA là 4:
P2O5 +4NaOH ->2NaH2PO4 +H2O
Tỉ lệ mol B: OA là 2:
P2O5 + 2NaOH +H2O ->2NaH2PO4
Lý thuyết oxit bazơ
Định nghĩa
Oxit bazơ thường là oxit của kim loại và tương ứng với một bazơ.
Ví dụ:
-
- CuO: bazơ tương ứng là đồng hidroxit Cu(OH)2
- Fe2O3: bazơ tương ứng là Fe(OH)3
- Na2O : bazơ tương ứng là NaOH
Tính chất hóa học
Tác dụng với nước: Chỉ có oxit bazơ của kim loại kiềm và kiềm thổ là tác dụng với nước. Những oxit bazơ tác dụng với nước và do đó cũng tan được trong nước là: Na2O, K2O, CaO, BaO, Li2O, Rb2O, Cs2O, SrO.
Công thức: R2On + nH2O —> 2R(OH)n (n là hóa trị của kim loại R).
R(OH)n tan trong nước, dung dịch thu được ta gọi chung là dung dịch bazơ hay dung dịch kiềm (dung dịch bazơ tan). Các dung dịch bazơ này thường làm giấy quì tím chuyển sang màu xanh và làm phenolphtalein từ không màu chuyển sang màu hồng.
Tác dụng với axit: Hầu hết các oxit bazơ tác dụng với axit (Thường là HCl hoặc H2SO4) tạo thành muối và nước.
Công thức: Oxit bazơ + Axit —> Muối + H2O
Tác dụng với oxit axit: Một số oxit bazơ tác dụng với oxit axit tạo thành muối. Thông thường đó là các oxit tác dụng được với nước (tan được trong nước).
Công thức: Oxit bazơ + Oxit axit —-> Muối
Ngoài ra, còn có oxit lưỡng tính và oxit trung tính
Oxit lưỡng tính: là oxit có thể tác dụng với axit hoặc bazơ tạo ra muối và nước. Ví dụ: Al2O3,ZnO
Oxit trung tính: là oxit không phản ứng với nước để tạo ra bazơ hay axit nhưng oxit này không phản ứng với bazơ hay axit để tạo muối. Ví dụ: Cacbon monoxit, Nitơ monoxit,..
Các dạng bài tập oxit axit tác dụng với oxit bazơ
Dạng 1: Dung dịch bazơ vừa đủ hoặc dư
Sản phẩm tạo thành : muối trung hòa (Na2CO3, CaCO3, …)
PTHH:
CO2 + 2NaOH → Na2CO3 + H2O
CO2 + Ca(OH)2 → CaCO3 + H2O
Dữ kiện cho: số mol oxit axit hoặc số mol bazơ.
Phương pháp giải:
– Bước 1: Đổi dữ kiện của đề bài đã cho ra số mol.
– Bước 2: Viết PTHH xảy ra.
– Bước 3: Tìm tỉ lệ số mol của các chất tham gia, các chất tạo thành.
– Bước 4: Từ tỉ lệ số mol theo PTHH tìm số mol có liên quan, rồi tính toán theo yêu cầu của đề bài và kết luận.
Dạng 2: Oxit axit dư
Sản phẩm tạo thành:
– Muối axit: CO2 dư hoàn toàn.
– Muối axit + muối trung hòa : CO2 dư một phần.
PTHH:
CO2 + 2NaOH → Na2CO3 + H2O (1)
CO2 dư : CO2 + Na2CO3 + H2O → 2NaHCO3 (2)
CO2 + Ca(OH)2 →CaCO3↓ + H2O
CO2 dư: CO2 + CaCO3↓ + H2O → Ca(HCO3)2
Dữ kiện cho: Số mol oxit axit, số mol bazơ.
Phương pháp giải:
– Bước 1: Đổi dữ kiện của đề bài đã cho ra số mol.
– Bước 2: Viết PTHH xảy ra.
– Bước 3: Tìm tỉ lệ số mol của các chất tham gia, các chất tạo thành. Từ pt (1) tìm được số mol muối trung hòa, số mol CO2 dư.
– Bước 4: Đặt số mol CO2 dư và muối trung hòa vào pt (2). Xác định CO2 dư hay muối trung hòa dư => Tính số mol các chất liên theo chất phản ứng hết trước.
– Bước 5: Tính toán theo yêu cầu của đề bài và kết luận.
Tổng kết so sánh oxit axit và oxit bazơ
Ngoài 2 loại oxit chủ yếu kể trên thì chương trình Hóa học 9 còn có 2 loại oxit khác là: oxit lưỡng tính và oxit trung tính. Bảng tổng kết dưới đây nhằm so sánh tính chất giữa các loại oxit với nhau.
Bảng tổng kết tính chất của từng loại oxit axit
Thông qua bài viết trên, congthuctoanlyhoa hi vọng đã có thể giúp bạn đọc hiểu rõ hơn về oxit axit và oxit bazơ nói riêng, cũng như hiểu về các loại oxit nói chung. Thông qua những kiến thức này, chúc bạn có thể hoàn thành tốt các bài học của mình.