Muối Natri Clorua (NaCl) là loại hợp chất vô cùng phổ biến trong tự nhiên và chúng ta đều có thể tiếp xúc hằng ngày. Bài viết dưới đây tổng hợp toàn bộ lý thuyết và bài tập về loại hợp chất Natri Clorua này!
Lý thuyết về muối Natri Clorua (NaCl)
Khái niệm
“Natri clorua là một hợp chất vô cơ có công thức hóa học là NaCl. Đây là muối chủ yếu tạo ra độ mặn trong các đại dương và chất lỏng ngoại bào của nhiều cơ thể đa bào. Đây cũng là thành phần chính trong muối ăn được sử dụng phổ biến làm gia vị hay chất bảo quản thực phẩm”.
Trạng thái tự nhiên
- NaCl là hợp chất rất phổ biến trong thiên nhiên. Nó có trong nước biển (khoảng 3% về khối lượng), nước của hồ nước mặn và trong khoáng vật halit (gọi là muối mỏ). Những mỏ muối lớn có lớp muối dày tới hàng trăm, hàng ngàn mét.
- Người ta thường khai tác muối từ mỏ bằng phương pháp ngầm, nghĩa là qua các lỗ khoan dùng nước hòa tan muối ngầm ở dưới lòng đất rồi bơm dung dịch lên để kết tinh muối ăn.
- Cô đặc nước biển bằng cách đun nóng hoặc phơi nắng tự nhiên, người ta có thể kết tinh muối ăn.
Tính chất
Tính chất vật lý
- Là hợp chất ion có dạng mạng lưới lập phương tâm diện. Tinh thể NaCl không có màu và hoàn toàn trong suốt.
- Nhiệt độ nóng chảy và nhiệt độ sôi cao, tonc= 800oC, tos= 1454oC.
- Dễ tan trong nước và độ tan không biến đổi nhiều theo nhiệt độ nên không dễ tinh chế bằng cách kết tinh lại.
- Độ tan của NaCl ở trong nước giảm xuống khi có mặt NaOH, HCl, MgCl2, CaCl2, … Lợi dụng tính chất này người ta sục khí HCl vào dung dịch muối ăn bão hòa để điều chế NaCl tinh khiết.
Tính chất hóa học
Khác với các muối khác, NaCl không phản ứng với kim loại, axit, bazơ ở điều kiện thường. Tuy nhiên, NaCl vẫn phản ứng với một muối:
NaCl + AgNO3 → NaNO3 + AgCl↓
Ở trạng thái rắn, NaCl phản ứng với H2SO4 đậm đặc (phản ứng sản xuất HCl, nhưng hiện nay rất ít dùng vì phương pháp tạo ra nhiều khí độc hại, gây nguy hiểm tới hệ sinh thái, ô nhiễm môi trường).
NaCl + H2SO4 → NaHSO4 + HCl
2NaCl + H2SO4 → Na2SO4 + 2HCl
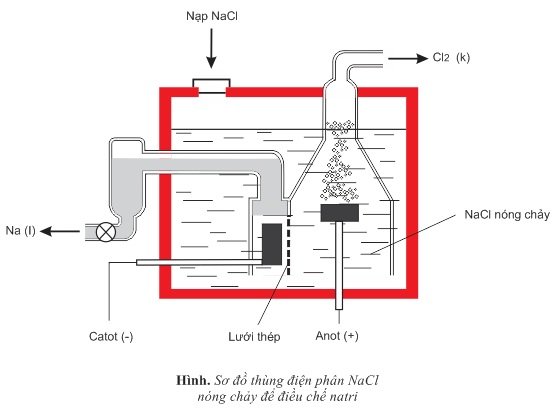
Điện phân dung dịch NaCl:
Ứng dụng
- Là nguyên liệu để điều chế Na, Cl2, HCl, NaOH và hầu hết các hợp chất quan trọng khác của natri.
- Ngoài ra, NaCl còn được dùng nhiều trong các ngành công nghiệp như thực phẩm (muối ăn…), nhuộm, thuộc da và luyện kim.
Lý thuyết về Kali Nitrat (KNO3)
Khái niệm
KNO3 có tên hóa học là kali nitrat là hợp chất thuộc nhóm muối nitrat. Thành phần gồm 13,8% nitơ và kali oxit chiếm 46,6%, còn có tên gọi khác là nitrat lửa hoặc nitrat đất.
Trạng thái tự nhiên
Là tinh thể hình thoi trong suốt không màu hoặc tinh thể kim cương hoặc bột trắng, không mùi, không độc hại, có vị mặn và cảm giác mát lạnh.
Tính chất
Tính chất vật lý
Tìm hiểu về muối kali nitrat không thể bỏ qua những tính chất vật lý như màu sắc, mùi vị, khối lượng mol, độ hòa tan… của nó.
-
Màu sắc: Muối kali nitrat là chất rắn màu trắng.
-
Mùi: Muối kali nitrat KNO3 không có mùi.
-
Khối lượng riêng: 2,109 g/cm3 (16 °C).
-
Điểm nóng chảy: 334 °C.
-
Sự phân hủy: Muối kali natri bị phân hủy ở nhiệt độ cao tạo thành muối kali nitrit và giải phóng oxi vì vậy nó có tính chất oxi hóa mạnh. Phương trình phản ứng như sau:
2KNO3 → t°2KNO2 + O2
Tính chất hóa học
Muối kali nitrat có thể tham gia nhiều phản ứng hóa học như: Phản ứng oxi hóa khử, phản ứng oxi hóa trong môi trường axit, phản ứng phân hủy để tạo oxi.
Cụ thể:
-
Phản ứng oxi hóa khử của muối kali nitrat KNO3
S + 2KNO3 + 3C → K2S + N2 + 3CO2
-
Phản ứng oxi hóa của muối kali nitrat trong môi trường axit
6FeSO4 + 2KNO3 (đậm đặc) + 4H2SO4 → K2SO4 + 3Fe2(SO4)3 + 2NO +4H2O
-
Phản ứng phân hủy tạo oxi
2KNO3 →t° 2KNO2 + O2
Ứng dụng
Ứng dụng KNO3 trong nông nghiệp
- KNO3 là một loại phân bón cung cấp các chất dinh dưỡng dạng đa lượng cho các loại cây trồng.
- Chúng còn là nguồn cung cấp kali tuyệt vời, là chất rất cần thiết cho sự phát triển của cây và hoạt động bình thường của mô. Kation kali (K+) đóng một phần quan trọng trong rất nhiều quá trình trao đổi chất ở trong tế bào, giúp điều hòa và tham gia vào một số quá trình cung cấp quản lý nước của cây.
- Bên cạnh đó, còn giúp cho cây trồng khỏe mạnh hơn và cho năng suất cây trồng tốt hơn.
- Sau khi được bón vào đất sẽ giúp đất giảm mặn, cải thiện tình hình sử dụng nước và giúp tiết kiệm nước khi trồng.
- KNO3 còn là thành phần chính không thể thiếu trong dinh dưỡng thủy canh, quyết định nhiều tới sự phát triển của các loại cây trồng, nếu như thiếu Kali hoặc Nitrat sẽ gây nên hiện tượng bị cháy mép lá, đốm đen lá hay vàng lá.
- Chúng còn giúp chống lại vi khuẩn, nấm gây bệnh, côn trùng và virus.
- Giảm đáng kể sự hấp thụ Cl của cây trồng, giúp chống lại các tác nhân gây hại của natri.
Ứng dụng trong chế tạo thuốc nổ
- Không thể không nhắc đến KNO3 để giúp chế tạo thuốc nổ đen với công thức: 75% KNO3, 10% S và 15% C. Khi nổ, nó sẽ tạo ra muối kali sunfua, khí nitơ và khí CO2, với công thức như sau:
2KNO3 + 3C + 5S → K2S + N2 + 3CO2
- Ngoài ra, nó còn dùng để tạo thành pháo hoa.
Trong ngành công nghiệp
Là chất phụ gia thực phẩm (E252), đây là một trong những cách để bảo quản thịt chống ôi thiu.
Vai trò quan trọng trong dược phẩm
- KNO3 được sử dụng trong một số loại kem đánh răng giúp cho răng nhạy cảm.
- Không chỉ có vậy, chúng được sử dụng để giúp điều trị bệnh hen suyễn và viêm khớp hiệu quả.
Bài tập muối quan trọng: Natri Clorua và Kali Nitrat
Bài tập liên quan đến muối Natri Clorua và Kali Nitrat thuộc chương trình Hóa học 9 bao gồm những dạng sau:
Bài 1
Bài 1 trang 36 SGK hóa 9: Có những muối sau: CaCO3, CaSO4, Pb(NO3)2, NaCl. Muối nào nói trên:
a) Không được phép có trong nước ăn vì tính độc hại của nó?
b) Không độc nhưng cũng không được có trong nước ăn vì vị mặn của nó?
c) Không tan trong nước, nhưng bị phân hủy ở nhiệt độ cao?
d) Rất ít tan trong nước và khó bị phân hủy ở nhiệt độ cao?
Hướng dẫn
a) Không được phép có trong nước uống vì tính độc hại: Pb(NO3)2
b) Không độc nhưng cũng không nên có trong nước uống vì vị mặn của nó: NaCl
c) Không tan trong nước nhưng bị phân hủy ở nhiệt độ cao: CaCO3
CaCO3 → CaO + CO2 (điều kiện nhiệt độ)
d) Rất ít tan trong nước và khó bị phân hủy ở nhiệt độ cao: CaSO4.
Bài 2
Hai dung dịch tác dụng với nhau, sản phẩm thu được có NaCl. Hãy cho biết hai cặp dung dịch các chất ban đầu có thể đã dùng. Minh họa bằng các phương trình hóa học.
Muối NaCl là sản phẩm của phản ứng hai dung dịch sau:
– Phản ứng trung hòa axit HCl bằng dung dịch bazo NaOH:
HCl + NaOH → NaCl + H2O
– Phản ứng trao đổi giữa:
Muối + axit: Na2CO3 + 2HCl → 2NaCl + CO2 ↑ + H2O
Muối + muối: Na2SO4 + BaCl2 → BaSO4 ↓ + 2NaCl
Na2CO3 + BaCl2→ BaCO3 ↓ + 2NaCl
Muối + Bazo: CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl.
Bài 3
a) Viết phương trình điện phân dung dịch muối ăn (có màng ngăn xốp).
b) Những sản phẩm của sự điện phân dung dịch NaCl ở trên có nhiều ứng dụng quan trọng:
– Khi clo dùng để: 1) … ; 2) … ; 3) …
– Khi hiđro dùng để: 1) … ; 2) … ; 3) …
– Natri hiđroxit dùng để: 1) … ; 2) … ; 3) …
Điền những ứng dụng sau đây vào những chỗ để trống ở trên cho phù hợp: Tẩy trắng vải, giấy; nấu xà phòng; sản xuất axit clohiđric; chế tạo hóa chất trừ sâu, diệt cỏ; hàn cắt kim loại; sát trùng, diệt khuẩn nước ăn; nhiên liệu cho động cơ tên lửa; bơm khí cầu, bóng thám không; sản xuất nhôm; sản xuất chất dẻo PVC; chế biến dầu mỏ.
a) 2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑ (dpmn)
b) Điền các chữ:
– Khí clo dùng để: 1) tẩy trắng vải, giấy; 2) sản xuất axit HCl; 3) sản xuất chất dẻo PVC.
– Khí hiđro dùng để: 1) hàn cắt kim loại; 2) làm nhiên liệu động cơ tên lửa; 3) bơm khí cầu, bóng thám không.
– Natri hiđroxit dùng để: 1) nấu xà phòng; 2) sản xuất nhôm; 3) chế biến dầu mỏ.
Tổng kết
Hi vọng thông qua bài viết này của congthuctoanlyhoa.com, các bạn đã có thể hiểu về lý thuyết cũng như bài tập của hai muối quan trọng đó là Natri Clorua (NaCl) và Kali Nitrat (KNO3).