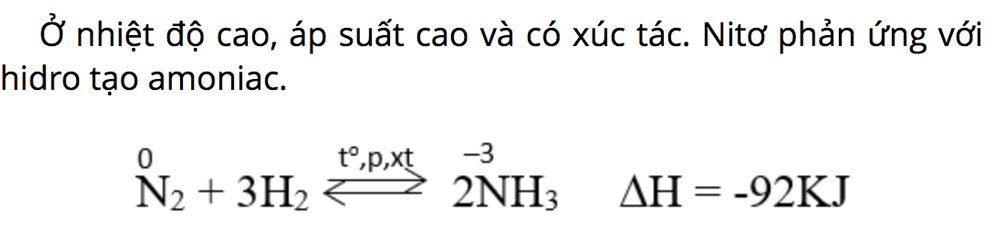Nitơ là khí được nhắc đến rất nhiều trong cuộc sống ngày nay, là thành phần chính của thực vật. Vậy khí Nitơ này có tính chất gì, ứng dụng, điều chế như thế nào? Cùng học ngay bài học hôm nay để cập nhật những kiến thức này nhé!
Vị trí và cấu hình electron nguyên tử Nitơ
Vị trí
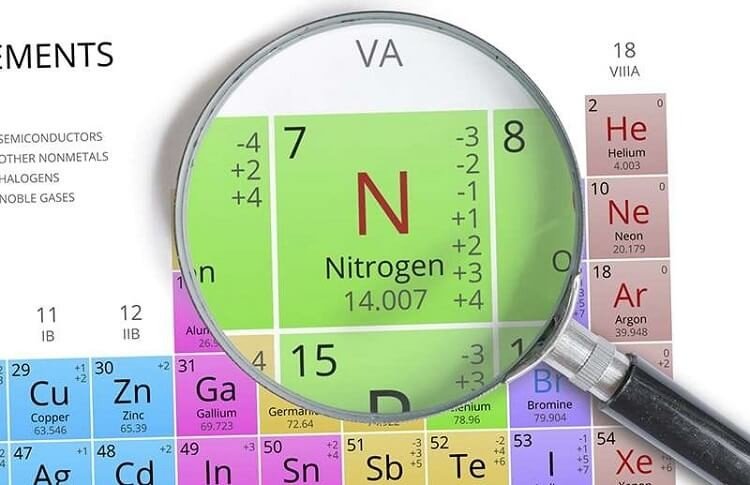
– Trong bảng tuần hoàn N nằm ở ô thứ 7, nhóm VA, chu kì 2.
– Cấu hình electron lớp ngoài cùng là 2s22p3.
– N có các số oxi hóa thường gặp: -3, 0, +1, +2, +3, +4, +5
– N có số oxi hóa cao nhất là +5, nhưng hóa trị cao nhất chỉ là 4.
Cấu tạo phân tử
- CTPT: N2
- CTCT: N ≡ N
Hai nguyên tử trong phân tử N2 có 3 liên kết cộng hóa trị không cực
Liên kết ba giữa hai nguyên tử N2 bền nên ở điều kiện thường N2 tương đối trơ và khó tham gia phản ứng hóa học.
Tính chất vật lí của Nitơ
Ở điều kiện thường N2 là:
+ Khí không màu, không mùi, không vị,
+ Hơi nhẹ hơn không khí (dN2/kk = 28/29), hóa lỏng ở -196oC; hóa rắn ở -210oC
+ Rất ít tan trong nước;
+ Không duy trì sự sống, sự cháy
Tính chất hóa học của Nitơ
Vì có số oxi hoá 0 nên N2 vừa thể hiện tính oxi hoá và tính khử (chủ yếu là tính oxi hóa)
Nito là phi kim khá hoạt động (độ âm điện = 3), nhưng ở nhiệt độ thường khá trơ về mặt hóa học. Do 2 nguyên tử N liên kết với nhau bằng 1 liên kết 3 không phân cực nên rất bền do năng lượng liên kết lớn
Tính oxi hóa
- Tác dụng với kim loại
Liti là kim loại duy nhất tác dụng được với nitơ ở nhiệt độ thường:
6Li + N2 → 2Li3N (liti nitrua)
Ở nhiệt độ cao, nitơ tác dụng với nhiều kim loại.
3Mg + N2 → Mg3N2( magie nitrua )
- Tác dụng với hidro:
Tính khử
N2 thể hiện tính khử khi tác dụng với chất có độ âm điện lớn hơn:
- Ở nhiệt độ cao (3000oC) N2 phản ứng với oxi tạo nitơ monoxit.
N2 + O2 ↔ 2NO (không màu)
- Ở điều kiện thường, nitơ monoxit tác dụng với oxi không khí tạo nitơ đioxit màu nâu đỏ.
2NO + O2 → 2NO2
Một số oxit khác của nitơ như N2O, N2O3, N2O5 chúng không điều chế trực tiếp từ nitơ và oxi
=> N2 thể hiện tính khử khi tác dụng với nguyên tố có độ âm điện lớn hơn (như O2), thể hiện tính oxi hóa khi tác dụng với nguyên tố có độ âm điện nhỏ hơn (như kim loại mạnh, H2)
Ứng dụng của Nitơ
Trong chương trình Hóa học 11, chúng ta được học về N2 với nhiều ứng dụng trong cuộc sống:
- Nitơ là thành phần dinh dưỡng chính của thực vật
- Trong công nghiệp:
+ Dùng để tổng hợp NH3, HNO3, phân đạm,…
+ Môi trường trơ trong luyện kin, thực phẩm, điện tử…
- Trong y tế: N2 lỏng được dùng để bảo quản mẫu máu, các mẫu vật sinh học
- Dựa vào tính trơ của N2 để bảo quản tranh vẽ trong bảo tàng (khí N2 có nhiều trong ống của cuộn tranh tránh các phân tử khác bị oxi hóa hư màu vẽ)
- Bơm N2 vào bóng đền điện để giảm sự bốc hơi kim loại trên bề mặt dây tóc
- Bơm N2 vào phổi bệnh nhân lao để ép lá phổi cho nó nghỉ ngơi
Trạng thái tự nhiên của Nitơ
Trong tự nhiên, nito tồn tại ở dạng tự do và dạng hợp chất.
– Ở dạng tự do, nito chiếm 80% thể tích không khí.
– Ở dạng hợp chất, nito có nhiều trong khoáng vật NaNO3 có tên là diêm tiêu natri.
Ngoài ra nito có trong thành phần của protein, axit ucleic, … và nhiều hợp chất hữu khác.
Điều chế Nitơ
Trong phòng thí nghiệm
Trong công nghiệp
Trong công nghiệp, người ta điều chế N2 bằng phương pháp chưng cất phân đoạn không khí lỏng.
Chưng cất phân đoạn không khí lỏng, thu nitơ ở -196 ºC, vận chuyển trong các bình thép, nén dưới áp suất 150 at.
Bài tập hóa học liên quan đến Nitơ
Bài 1: Trong một bình kín dung tích 10 lít có chứa 21g N2 . Hãy tính áp suất của khí trong bình, biết nhiệt độ của khí bằng 25oC?
Hướng dẫn:
Số mol khí N2 là 21/28 = 0,75 (mol)
=> Áp suất của N2:
p = nRT : v = [0,75.0,082(25+273)] : 10 = 1,83 (atm)
Bài 2: Cần lấy bao nhiêu lít khi nito và khí hidro để điều chế được 67,2 lít khí aminiac? Biết rằng thể tích của các khí đều được đo trong cùng điều kiện nhiệt độ, áp suất và hiệu suất của phản ứng là 25%
Hướng dẫn:
Phương trình phản ứng:
3H2 + N2⇔ 2NH3
4,5 1,5 3 mol
Hiệu suất 25% => Thể tích khí nitơ (đktc):
VN2 = 1,5.22,4. (100/25) = 134,4 (lít)
Thể tích khi hidro:
VH2 = 4,5. 22,4.(100/25) = 403,2 (lít)
Tổng kết
Như vậy congthuctoanlyhoa.com vừa cùng các bạn học về kiến thức mới của bài Nitơ. Các bạn hãy ghi chép thật kỹ và chú ý đến các bài tập để ứng dụng thật tốt nhé! Chúc các bạn học tốt!