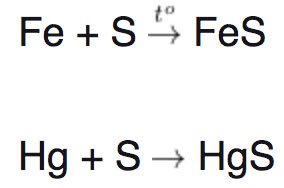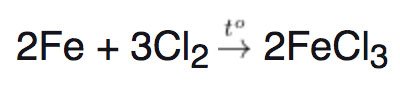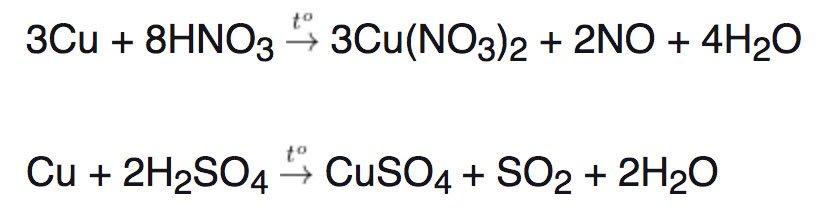Tổng hợp toàn bộ lý thuyết về dãy điện hóa của kim loại: khái niệm, tính chất, ý nghĩa. Bên cạnh đó là tổng hợp các tính chất vật lý lẫn hóa học của kim loại. Cùng congthuctoanlyhoa tham khảo bài viết để hiểu rõ hơn về kiến thức trọng tâm này nhé!
Dãy điện hóa của kim loại
Khái niệm dãy điện hóa của kim loại
Dãy điện hóa của kim loại hay còn gọi là dãy hoạt động hóa học của kim loại, là danh sách các kim loại được liệt kê theo thứ tự giảm dần khả năng phản ứng hoặc theo thứ tự giảm dần tính dễ oxi hóa.
Các kim loại ở đầu dãy điện hóa như kim loại kiềm và kim loại kiềm thổ, phản ứng mạnh hơn hoặc dễ bị oxi hóa hơn các kim loại ở cuối dãy như kim loại vàng, bạc.
Về cơ bản, điều này có nghĩa là chúng có thể phản ứng dễ dàng hơn để tạo thành các hợp chất. Những kim loại ở đầu dãy hoạt động được gọi là kim loại hoạt động mạnh và kim loại ở cuối dãy gọi là kim loại hoạt động yếu.
Dãy điện hóa của kim loại
Sắp xếp theo tính oxi hóa của kim loại tăng:
K+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Ni2+ Sn2+ Pb2+ H+ Cu2+ Ag+ Au3+
Săp xếp theo tính khử của kim loại tăng: K Na Mg Al Zn Fe Ni Sn Pb H Cu Ag Au
Ý nghĩa dãy điện hóa của kim loại
– So sánh tính oxi hóa – khử: Tính oxi hóa của ion Mn+ càng mạnh thì tính khử của kim loại M càng yếu và ngược lại. Cụ thể như kim loại Na có tính khử mạnh do đó ion Na+ có tính oxi hóa yếu. Ion Ag+ có tính oxi hóa mạnh do đó kim loại Ag có tính khử yếu.
– Xác định chiều phản ứng oxi hóa – khử: Dãy điện hóa của kim loại cho phép dự đoán chiều của phản ứng giữa hai cặp oxi hóa – khử theo quy tắc alpha: Phản ứng giữa hai cặp oxi hóa – khử sẽ xảy ra theo chiều chất oxi hóa mạnh hơn sẽ oxi hóa chất khử mạnh hơn, sinh ra oxi hóa yếu hơn và chất khử yếu hơn.
– Để xét một phản ứng oxi hóa – khử có xảy ra hay không cần nắm được quy tắc alpha: Chất khử mạnh + chất oxi hóa mạnh -> chất oxi hóa yếu hơn + chất khử yếu hơn.
Mẹo học thuộc nhanh dãy điện hóa của kim loại
Để nhớ nhanh dãy điện hóa của kim loại thuộc chương trình Hóa học 12, ta có bài thơ sau:
K Na Ba Ca Mg Al
Khi Nào Bạn Cần May Áo Dài
Fe Ni Sn Pb H
Phái Người Sang Phố Hỏi
Cu Hg Ag Pt Au
Cửa Hàng Á Phi Âu
K Na Li Ba Ca Mg Al
Không Nói Li Biệt Chiều Mưa Ấy
Mn Zn Fe Co Ni Sn Pb
Mắt Dõi Phương Cũ Nhớ Thương Chờ
H Cu Bi Hg Ag Pt Au
Hỏi Có Biết Hay Ai Phố Vắng
Dãy điện hóa O sau khử trước (1)
Phản ứng theo quy ước (2) anpha (?)
Nhưng cần phải hiểu sâu xa
Trước sau ý nghĩa mới là thành công
Kali, Can, Nát tiên phong
Ma, Nhôm, Man, Kẽm tiếp không chịu hèn
Sắt rồi Cô đến Niken
Thiếc, Chì dẫu chậm cũng liền theo chân
Hidro, Đồng, Bạc, Thủy Ngân
Bạch kim, Vàng nữa chịu phần đứng sau.
Ba kim (loại) mạnh nhất ở đầu
Vào dung dịch muối nước đâu “hủy liền”.
Khí bay, muối lại gặp kiềm
Đổi trao phản ứng là quyền chúng thôi.
Các kim loại khác dễ rồi,
Vào dung dịch muối trước thời đẩy sau.
Với axit, nhớ bảo nhau:
Khử được hát cộng (H+), phải đâu dễ dàng.
Từ Đồng cho đến cuối hàng,
Sau Hidro đấy, chẳng tan chút nào.
Vài lời bàn bạc , đổi trao,
Vun cây “Vườn hóa” vui nào vui hơn
Tính chất của kim loại trong dãy điện hóa
Tính chất vật lý
1. Tính chất vật lí chung
a) Tính dẻo
Kim loại có tính dẻo là do các ion dương trong mang tinh thể kim loại có thể trượt lên nhau một cách dễ dàng mà không bị tạch khỏi nhau nhờ các electron tự do.
=> Kim loại có tính dẻo nhất là Au
b) Tính dẫn điện
Khi đặt một hiệu điện thế vào hai đầu dây kim loại , nhưng electron chuyển động tự do sẽ chuyển động thành dòng có hướng từ âm đến dương.
=> Khả năng dẫn điện của một số kim loại Ag > Cu > Au > Al > Fe
c) Tính dẫn nhiệt
Kim loại có tính dẫn nhiệt là do có các electron tự do trong mạng tinh thể.
d) Tính ánh kim
Các electron tự do trong mạng tinh thể phản xạ hầu hết những tia sáng nhìn thấy được
=> Tính chất vật lí chung của kim loại như nói ở trên gây nên bởi sự có mặt của các electron tự do trong mạng tinh thể kim loại.
2. Tính chất vật lí riêng
a) Tính cứng
=> Kim loại mềm nhất là Cs, kim loại cứng nhất là Cr
b) Nhiệt độ nóng chảy
=> Kim loại dễ nóng chảy nhất là Hg (-39 độ C), khó nóng chảy nhất là W
c) Khối lượng riêng
– Kim loại có khối lượng riêng D < 5 gam/cm3 là kim loại nhẹ (Na, Li, Mg, Al,…)
– Kim loại có khối lượng riêng D > 5 gam/cm3 là kim loại nặng.( Cr, Fe, Zn, Pb, Ag, Hg,…)
Tính chất hóa học
Tính chất hoá học đặc trưng chung của các kim loại là tính khử.
M → Mn+ +ne (1 ≤ n ≤ 3)
1. Phản ứng với phi kim
Tác dụng với oxi
– Oxi có thể tác dụng với tất cả các kim loại trừ Ag, Au, Pt để tạo thành oxit bazo hoặc oxit lưỡng tính theo công thức tổng quát: 2xM +yO2 2MxOy
– Kim loại càng mạnh sẽ phản tứng với oxi càng mãnh liệt, mức độ phản ứng sẽ giảm dần theo độ mạnh yếu của kim loại tham gia phản ứng.
+ Natri và Kali khi cháy trong lượng oxi thiếu thì tạo thành oxit, còn nếu dư oxi thì tạo thành peoxit.
+ Sắt, kẽm, nhôm, magie khi tác dụng với oxi sẽ tạo thành oxit.
+ Các kim loại không cháy nhưng tạo thành oxit trên bề mặt: Pb -> Hg
+ Các kim loại không cháy và không tạo thành oxit trên bề mặt: Ag -> Au
– Thông qua lớp oxit trên bề mặt, nếu không khít là phản ứng với kim loại xảy ra hoàn toàn, còn khít là phản ứng chỉ xảy ra trên bề mặt của kim loại.
Chú ý: Hầu hết các kim loại (trừ Ag, Au, Pt) phản ứng với oix ở nhiệt độ thường hoặc nhiệt độ cao tạo thành oxit.
Tác dụng với lưu huỳnh
– Lưu huỳnh sẽ bị khử bởi tất cả các kim loại trong phản ứng đun nóng từ số oxi hóa 0 xuống -2. Chỉ có Hg là kim loại duy nhất tác dụng với lưu huỳnh ở nhiệt độ thường.
Tác dụng với clo
– Clo bị hầu hết các kim loại khử trực tiếp và tạo thành sản phẩm là muối clorua.
2. Phản ứng với dung dịch axit
Tác dụng với dung dịch HCl và H2SO4 loãng (trừ Cu, Ag, Au, Pt)
– Các kim loại đứng trước H2 trong dãy điện hóa mới tác dụng được với H2SO4 loãng và HCl và tạo ra muối (kim loại có hóa trị thấp) và H2
Fe + H2SO4 loãng FeSO4 + H2
Mg + HCl loãng MgCl2 +H2
Lưu ý:
– Na, K,Ca, Ba khi cho tác dụng với dung dịch H2SO4 loãng và HCl sẽ xảy ra phản ứng với H+ trước, nếu còn dư sẽ phản ứng với H2O.
– Pb mặc dù đứng trước H2 trong dãy điện hóa nhưng không tác dụng được với H2SO4 loãng và HCl do muối tạo ra khó tan và bám trên mặt gây cản trở phản ứng.
Tác dụng với axit H2SO4 đặc nóng và HNO3 đặc nóng
– Kim loại tác dụng với H2SO4 đặc/HNO3 sẽ tạo ra muối ( kim loại có hóa trị cao nhất) + sản phẩm khử và H2O. Chỉ có Au và Pt không có phản ứng này.
Chú ý: Al, Fe, Cr không tác dụng với H2SO4 đặc nguội
3. Phản ứng với dung dịch muối
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Nhận xét:Cu hoạt động hóa học mạnh hơn Ag
Fe + CuSO4 → FeSO4 + Cu
Nhận xét: Fe hoạt động hóa học mạnh hơn Cu
=> Hoạt động hóa học của Fe > Cu > Ag
Lưu ý: Kim loại hoạt động hóa học mạnh hơn (trừ Na, K, Ca, Ba…) có thể đẩy kim loại hoạt động yếu hơn ra khỏi dung dịch muối, tạo thành muối mới và kim loại mới.
4. Phản ứng với nước
– Kim loại kiềm (Li, Na, K, Rb, Cs) và kiềm thổ (Ca, Sr, Ba):
Những kim loại mạnh như Li, Na, Ca,… có thể tác dụng với nước ở điều kiện nhiệt độ phòng để tạo ra các dung dịch bazơ và giải phóng khí H2.
– Các kim loại như: Mg, Zn, Fe,…
Các kim loại trung bình như Mg, Fe,… cần điều kiện nhiệt độ cao mới có thể phản ứng với nước để tạo thành oxit kim loại (trừ Mg tan chậm trong nước nóng tạo thành dung dịch Mg(OH)2) và khí hiđro.
– Các kim loại không tác dụng với nước
Khác với những kim loại đã nêu trên, một số kim loại như Be, Cu, Ag, Hg,… không tác dụng được với nước.
Tổng kết
Hi vọng thông qua bài viết trên của congthuctoanlyhoa.com, các bạn đã có thể nắm vững được kiến thức về dãy điện hóa của kim loại và tính chất của kim loại.