Cùng congthuctoanlyhoa khám phá Lý thuyết Sulfur và sulfur dioxide chi tiết, đầy đủ. Bài viết cung cấp cho các em cái nhìn sâu sắc về tính chất vật lý, tính chất hoá học, ứng dụng của Sulfur và sulfur dioxide và các bài tập về Sulfur và sulfur dioxide. Bài viết này sẽ hỗ trợ cho các em trong việc học tốt môn Hoá học 11.
A/ Lý thuyết Sulfur và sulfur dioxide
I. Sulfur
1. Trạng thái tự nhiên
– Sulfur (lưu huỳnh) là nguyên tố phổ biến thứ 17 trên vỏ Trái Đất, chiếm khoảng 0,03 – 0,1% khối lượng, tồn tại ở bốn dạng đồng vị bền: 32S (94,98%), 33S (0,76%), 34S (4,22%) và 36S (0,02%). Trong tự nhiên, sulfur tồn tại ở cả dạng đơn chất và dạng hợp chất. Đơn chất sulfur được phân bố ở vùng lân cận núi lửa và suối nước nóng,… Hợp chất sulfur gồm các khoáng vật sulfide, sulfate, protein,…
– Sulfur được giải phóng ra khỏi lõi Trái Đất chủ yếu ở dạng sulfur dioxide (SO2) và hydrogen sulfide (H2S) khi núi lửa hoạt động. Sau đó, hydrogen sulfide chuyển hoá thành muối sulfide ít tan (tạo thành các khoáng vật pyrite, chalcopyrite,…) và sulfur dioxide chuyển hoá thành muối sulfate của calcium, barium (tạo thành các khoáng vật như thạch cao). Trong cơ thể người, sulfur chiếm khoảng 0,2% khối lượng, có trong thành phần nhiều protein và enzyme.
2. Cấu tạo nguyên tử, phân tử
a, Cấu tạo nguyên tử
– Vị trí trong BTH:
+ Ô: 16.
+ Chu kì: 3.
+ Nhóm: VIA.
– Sulfur có tính phi kim.
– Số oxi hóa: -2, 0, +4, +6.
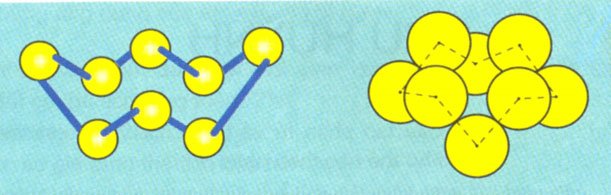
b, Cấu tạo phân tử
Phân tử sulfur gồm 8 nguyên tử (S8) có dạng vòng khép kín.
Mỗi nguyên tử sulfur liên kết với hai nguyên tử bên cạnh bằng hai liên kết CHT không phân cực.
3. Tính chất vật lí
Đơn chất sulfur có hai dạng thù hình: dạng tà phương (bền ở nhiệt độ thường) và dạng đơn tà.
Sulfur không tan trong nước, ít tan trong alcohol, tan nhiều trong carbon disulfide.
Sulfur nóng chảy ở 113 oC và sôi ở 445 oC.
4. Tính chất hóa học
a, Tác dụng với hydrogen và kim loại
– Tác dụng với hydrogen
S(s) +H2(g) H2S(g)
– Tác dụng với kim loại tạo ra muối sulfide
Hg + S → HgS
2Al + 3S → Al2S3
b, Tác dụng với phi kim
S + 3F2 → SF6
S + O2 → SO2
5. Ứng dụng
Một số ứng dụng của sulfur được thể hiện trong sơ đồ sau:
II. Sulfur dioxide
1. Tính chất vật lí
– SO2 là chất khí không màu, năng hơn không khí, mùi hắc, tan nhiều trong nước.
– SO2 là khí độc, hít thở không khí chứa sulfur dioxide vượt ngưỡng cho phép sẽ gây viêm đường hô hấp.
2. Tính chất hoá học
a) Tính oxi hoá
Sulfur dioxide tác dụng với hydrogen sulfide tạo thành sulfur và nước.
SO2 + 2H2S → 3S + 2H2O
Trong thực tiễn, phản ứng trên được dùng để chuyển hoá hydrogen sulfide trong khí thiên nhiên thành sulfur.
b) Tính khử
Sulfur dioxide tác dụng với nitrogen dioxide (NO2) khi có xúc tác nitrogen oxide để chuyển hoá thành sulfur trioxide.
SO2 + NO2 SO3 + NO
Trong không khí, sulfur dioxide chuyển hoá thành sulfur trioxide, sau đó kết hợp với hơi nước tạo thành sulfuric acid. Đây là phản ứng giải thích quá trình hình thành mưa acid khi không khí bị ô nhiễm bởi sulfur dioxide.
3. Ứng dụng
– Là chất trung gian quan trọng trong quá trình sản xuất sulfuric acid.
– Tẩy trắng và diệt khuẩn.
– Là dung môi để thực hiện nhiều phản ứng.
4. Sulfur dioxide và ô nhiễm môi trường
a) Nguồn phát sinh sulfur dioxide
Sulfur dioxide được sinh ra từ cả nguồn tự nhiên (khí thải núi lửa) và nguồn nhân tạo. Trên toàn thế giới, nguồn sulfur dioxide tự nhiên chiếm ưu thế, nhưng ở các khu vực đô thị và công nghiệp, nguồn nhân tạo chiếm ưu thế.
Nguồn sulfur dioxide nhân tạo chủ yếu sinh ra từ quá trình đốt cháy nhiên liệu có chứa tạp chất sulfur (than đá, dầu mỏ), đốt quặng sulfide (galen, blend) trong luyện kim, đốt sulfur và quặng pyrite trong sản xuất sulfuric acid,….
b) Tác hại
Sulfur dioxide là một trong các tác nhân làm ô nhiễm khí quyển, gây mưa acid và viêm đường hô hấp ở người…
c) Biện pháp cắt giảm phát thải sulfur dioxide vào khí quyển
Dựa trên các nguồn phát sinh sulfur dioxide do hoạt động của con người, các biện pháp để cắt giảm sự phát thải khí này được đề xuất như sau: tăng cưởng sử dụng các nguồn năng lượng mới, năng lượng sạch, năng lượng tái tạo; sử dụng tiết kiệm, hiệu quả nguồn tài nguyên thiên nhiên; cải tiến công nghệ sản xuất, có biện pháp xử lí khí thải và tái chế các sản phẩm phụ có chứa sulfur.
B/ Bài tập Sulfur và sulfur dioxide
Bài 1: Sulfur được dân gian sử dụng để pha chế vào thuốc trị các bệnh ngoài da. Tên gọi dân gian của sulfur là
A. diêm sinh.
B. đá vôi.
C. phèn chua.
D. giấm ăn.
Lời giải:
Đáp án đúng là: A
Trong dân gian, sulfur có tên gọi là diêm sinh.
Bài 2: Trong tự nhiên, đồng vị của sulfur chiếm thành phần nhiều nhất là
A.34S.
B. 32S.
C. 36S.
D. 33S.
Lời giải:
Đáp án đúng là: B
Trong tự nhiên, đồng vị của sulfur chiếm thành phần nhiều nhất là 32S (≈ 95%).
Bài 3: Thạch cao sống là một đạng tồn tại phổ biến của sulfur trong tự nhiên, được sử dụng làm nguyên liệu để sản xuất xi măng, phấn viết bảng,… Công thức của thạch cao sống là
A. BaSO4.
B. CaSO4.2H2O.
C. MgSO4.
D. CaSO4.5H2O.
Lời giải:
Đáp án đúng là: B
Thạch cao sống có công thức là CaSO4.2H2O.
Bài 4 : Ở điều kiện thường, sulfur tồn tại ở dạng tinh thể, được tạo nên từ các phân tử sulfur. Số nguyên tử trong mỗi phân tử sulfur là
A. 2.
B. 4.
C. 6.
D. 8.
Lời giải:
Đáp án đúng là: D
Phân tử sulfur trong trạng thái rắn tồn tại ở dạng vòng gồm có 8 nguyên tử sulfur.
Vậy là các em đã tìm hiểu xong bài học về Lý thuyết và Bài tập Sulfur và sulfur dioxide. Mong các em sẽ học ngày càng tốt hơn nữa môn Hoá 11.
![[Hoá học 11] Lý thuyết Sulfur và sulfur dioxide](https://congthuctoanlyhoa.com/wp-content/uploads/2024/04/5-8.jpg)

![[Hoá học 11] Lý thuyết Sulfur và sulfur dioxide](https://congthuctoanlyhoa.com/wp-content/uploads/2024/04/6-7.jpg)