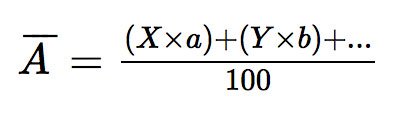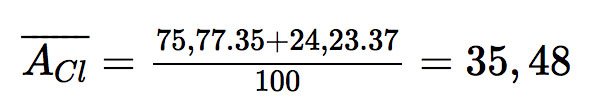Cùng congthuctoanlyhoa khám phá Lý thuyết và Bài tập Nguyên tố hóa học chi tiết, đầy đủ. Bài viết cung cấp cho các em cái nhìn sâu sắc về Nguyên tố hóa học, Kí hiệu nguyên tử, Đồng vị, Nguyên tử khối và các bài tập về Nguyên tố hóa học. Bài viết này sẽ hỗ trợ cho các em trong việc học tốt môn Hoá học lớp 10.
A/ Lý thuyết Nguyên tố hóa học
I. Nguyên tố hóa học
– Nguyên tố hóa học là tập hợp những nguyên tử có cùng số đơn vị điện tích hạt nhân.
Ví dụ: Protium; deuterium và tritium là các loại nguyên tử của nguyên tố hydrogen.
– Trong nguyên tử, số đơn vị điện tích hạt nhân bằng số electron ở vỏ nguyên tử.
– Các electron trong nguyên tử quyết định tính chất hóa học của nguyên tử, nên các nguyên tử của cùng một nguyên tố hóa học có tính chất hóa học giống nhau.
– Hiện nay, con người đã biết 118 nguyên tố hóa học, trong đó có 94 nguyên tố hóa học tồn tại trong tự nhiên và 24 nguyên tố hóa học được tạo ra trong phòng thí nghiệm.
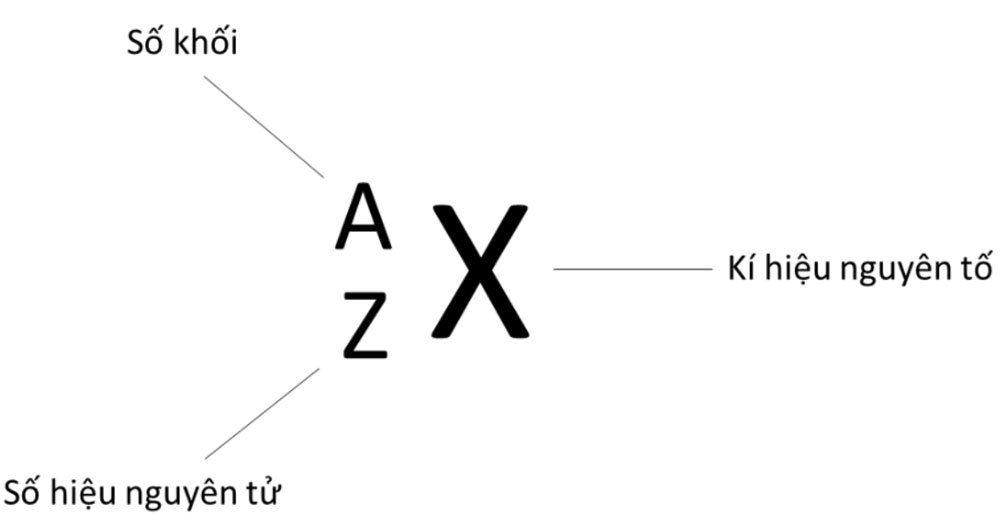
II. Kí hiệu nguyên tử
– Số đơn vị điện tích hạt nhân nguyên tử của một nguyên tố hóa học (còn được gọi là số hiệu nguyên tử (Z)) của nguyên tố đó và số khối (A) là những đặc trưng cơ bản của 1 nguyên tử.
Ví dụ: Kí hiệu cho biết:
– Nguyên tử sodium có kí hiệu là Na
– Số hiệu nguyên tử sodium = 11 nên hạt nhân sodium có 11 proton, vỏ nguyên tử có 11 electron
– Số khối của nguyên tử Na là 23 nên trong hạt nhân có số neutron là 23 – 11 = 12
III. Đồng vị
– Đồng vị là những nguyên tử có cùng số đơn vị điện tích hạt nhân (cùng số proton) nhưng có số neutron khác nhau.
Ví dụ: Hydrogen có 3 đồng vị là:
– Các đồng vị khác nhau về số neutron nên khác nhau về khối lượng hạt nhân nguyên tử, đồng thời khác nhau về một số tính chất vật lí.
– Ngoài các đồng vị bền, các nguyên tố hóa học còn có một số đồng vị không bền, gọi là các đồng vị phóng xạ, được sử dụng nhiều trong đời sống, y học, nghiên cứu khoa học…
IV. Nguyên tử khối
1. Nguyên tử khối
– Nguyên tử khối là khối lượng tương đối của nguyên tử.
– Nguyên tử khối của một nguyên tử cho biết khối lượng của nguyên tử đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử.
– Do khối lượng proton và neutron đều xếp xỉ 1 amu, còn khối lượng neutron nhỏ hơn rất nhiều (0,00055 amu), nên một cách gần đúng, coi nguyên tử khối xấp xỉ số khối của hạt nhân.
2. Nguyên tử khối trung bình
– Nguyên tử khối của một nguyên tố là nguyên tử khối trung bình (kí hiệu là ) của hỗn hợp các đồng vị của nguyên tố đó.
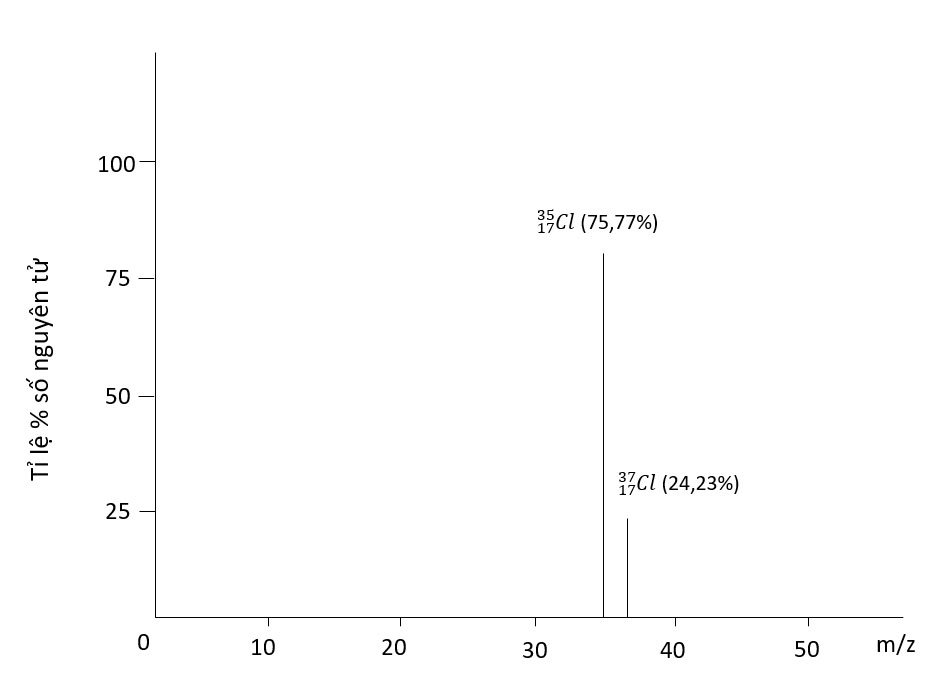
– Muốn xác định giá trị nguyên tử khối trung bình của một nguyên tố, ta cần phải biết được phần trăm số nguyên tử các đồng vị của nguyên tố đó trong tự nhiên. Người ta thường dùng phương pháp phổ khối lượng để xác định phần trăm số nguyên tử các đồng vị tự nhiên của các nguyên tố.
– Công thức tính nguyên tử khối trung bình của nguyên tố :
Trong đó:
: là nguyên tử khối trung bình
X, Y: lần lượt là nguyên tử khối của các đồng vị X, Y,…
a, b: lần lượt là tỉ lệ % số nguyên tử của các đồng vị X, Y.
Ví dụ: Bằng phương pháp phổ khối lượng, người ta xác định được trong tự nhiên, nguyên tố chlorine có 2 đồng bị bền là (chiếm 75,77%) và
(chiếm 24,23% số nguyên tử).
Nguyên tử khối trung bình của chlorine là:
B/ Bài tập Nguyên tố hóa học
Bài 1. Nguyên tử Al có điện tích hạt nhân là 13+. Trong nguyên tử Al số hạt mang điện nhiều hơn số hạt không mang điện là 12 hạt. Hãy cho biết số khối của nhôm.
Đáp án hướng dẫn giải chi tiết
Ta có: Điện tích hạt nhân của Al là 13+, tức p = 13 (1)
Theo đề bài ta có: (p + e) – n = 12 (2)
Giải (1) và (2) ta được n= 14
Số khối A = p + n = 13 + 14 = 27
Vậy số khối của Al là 27.
Bài 2. Trong tự nhiên nguyên tố Brom có 2 đồng vị, trong đó đồng vị chiếm 54,5% về số lượng. Số khối của đồng vị còn lại bằng bao nhiêu
Đáp án hướng dẫn giải chi tiết
Đặt A2 là số khối của đồng vị thứ hai
Phần trăm số lượng của nó là: 100 – 54,5 = 45,5
Ta có:
Bài 3. Nguyên tố Bạc có 2 đồng vị trong tự nhiên là 107Ag chiếm 51,839% số nguyên tử. Tính số khối của đồng vị còn lại biết trong AgCl bạc chiếm 75,254% về khố lượng. Cho Cl = 35,5
Đáp án hướng dẫn giải
Gọi nguyên tử khối của bình của Ag là M.
→ %mAg =M/(M + 35,5) = 75,254%
→ M = 107,9575
Gọi số khối của đồng vị còn lại là x, đồng vị này chiếm 48,161%
→ 107.51,839% + x.48,161% = 107,9575 → x = 109
Vậy là các em đã tìm hiểu xong bài học về Lý thuyết và Bài tập Nguyên tố hóa học. Mong các em sẽ học ngày càng tốt hơn nữa môn Hoá học 10.