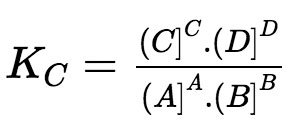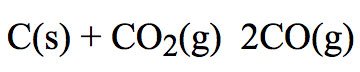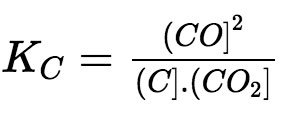Cùng congthuctoanlyhoa khám phá Lý thuyết Khái niệm về cân bằng hoá học chi tiết, đầy đủ. Bài viết cung cấp cho các em cái nhìn sâu sắc về Phản ứng một chiều và phản ứng thuận nghịch, Cân bằng hóa học, Các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hoá học và các bài tập về Khái niệm về cân bằng hoá học. Bài viết này sẽ hỗ trợ cho các em trong việc học tốt môn Hoá học 11.
A/ Lý thuyết Khái niệm về cân bằng hoá học
I. Phản ứng một chiều và phản ứng thuận nghịch
1. Phản ứng một chiều
Trong điều kiện xác định, phản ứng xảy ra theo chiều từ chất tham gia tạo thành sản phẩm mà sản phẩm không thể tác dụng với nhau để tạo thành chất ban đầu, gọi là phản ứng một chiều.
Phương trình hoá học của phản ứng một chiều được biểu diễn bằng mũi tên chỉ chiều phản ứng.
Ví dụ:
NaOH + HCl → NaCl + H2O
2. Phản ứng thuận nghịch
Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều ngược nhau trong cùng điều kiện.
Phương trình hoá học của phản ứng thuận nghịch được biểu diễn bằng hai nửa mũi tên ngược chiều nhau. Chiều từ trái sang phải là chiều phản ứng thuận, chiều từ phải sang trái là chiều phản ứng nghịch.
Ví dụ:
Cl2 + H2O ⇌ HCl + HClO
Trong thực tế, các phản ứng thuận nghịch xảy ra không hoàn toàn, bởi vì trong cùng một điều kiện, các chất phản ứng tác dụng với nhau tạo thành chất sản phẩm (phản ứng thuận), đồng thời các chất sản phẩm lại tác dụng với nhau tạo thành các chất ban đầu (phản ứng nghịch).
II. Cân bằng hóa học
1. Trạng thái cân bằng
– Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái tại đó tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
2. Hệ số cân bằng
a, Biểu thức của hằng số cân bằng.
– Xét phản ứng thuận nghịch tổng quát: aA + bB cC + dD.
Ở trạng thái cân bằng, hằng số cân bằng (KC) được xác định theo biểu thức:
Trong đó:
+ (A], (B], (C], (D] là nồng độ mol của các chất A, B, C, D ở trạng thái cân bằng.
+ a, b, c, d là hệ số tỉ lượng của các chất trong phương trình hóa học của phản ứng.
– Ví dụ: Xét phản ứng:
b, Ý nghĩa của hằng số cân bằng
– Hằng số cân bằng KC phụ thuộc vào bản chất của phản ứng và nhiệt độ.
– KC càng lớn thì phản ứng thuận càng chiếm ưu thế và ngược lại.
III. Các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hoá học
1. Ảnh hưởng của nhiệt độ
Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều làm giảm nhiệt độ, tức là chiều phản ứng thu nhiệt , nghĩa là chiều làm giảm tác động của việc tăng nhiệt độ và ngược lại.
2. Ảnh hưởng của nồng độ
Khi tăng nồng độ của một chất trong phản ứng thì cân bằng hoá học bị phá vỡ và chuyển dịch theo chiều làm giảm nồng độ của chất đó và ngược lại.
3. Ảnh hưởng của áp suất
Khi tăng áp suất chung của hệ, thì cân bằng chuyển dịch theo chiều làm giảm áp suất, tức là chiều làm giảm số mol khí và ngược lại.
Đối với phản ứng thuận nghịch có tổng hệ số tỉ lượng của các chất khí ở hai vế của phương trình hoá học bằng nhau thì trạng thái cân bằng của hệ không bị chuyển dịch khi thay đổi áp suất chung của hệ.
4. Nguyên lí chuyển dịch cân bằng Le Chatelier
Một phản ứng thuận nghịch đang ở trạng thái cân bằng, khi chịu một tác động bên ngoài làm thay đổi nồng độ, nhiệt độ, áp suất thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.
Nguyên lí chuyển dịch cân bằng Le Chatelier có ý nghĩa rất lớn khi được vận dụng vào kĩ thuật công nghiệp hoá học. Người ta có thể thay đổi các điều kiện để chuyển dịch cân bằng theo chiều mong muốn, làm tăng hiệu suất của phản ứng.
Chú ý:
Ngoài ra, để tăng tốc độ phản ứng người ta còn sử dụng chất xúc tác.
Chất xúc tác là chất làm tăng tốc độ phản ứng nhưng không bị biến đổi (cả về chất và lượng) sau khi phản ứng kết thúc.
B/ Bài tập Khái niệm về cân bằng hoá học
Câu 1: Quá trình hình thành hang động, thạch nhũ là một ví dụ điển hình về phản ứng thuận nghịch trong tự nhiên.
Nước có chứa CO2 chảy qua đá vôi, bào mòn đá tạo thành Ca(HCO3)2, (phản ứng thuận) góp phần hình thành các hang động. Hợp chất Ca(HCO3)2 trong nước lại bị phân huỷ tạo ra CO2 và CaCO3 (phản ứng nghịch), hình thành các thạch nhũ, măng đá, cột đá.
Viết phương trình hoá học của các phản ứng xảy ra trong hai quá trình trên.
Lời giải:
CaCO3 + H2O + CO2 → Ca(HCO3)2
Ca(HCO3)2 → CaCO3 + H2O + CO2
Câu 2: Phản ứng xảy ra khi cho khí Cl2 tác dụng với nước là một phản ứng thuận nghịch. Viết phương trình hoá học của phản ứng, xác định phản ứng thuận, phản ứng nghịch.
Lời giải:
Cl2+ H2O → HCl + HClO (phản ứng thuận).
HCl + HClO → Cl2+ H2O (phản ứng nghịch).
Câu 3: Nhận xét nào sau đây không đúng?
A. Trong phản ứng một chiều, chất sản phẩm không phản ứng được với nhau tạo thành chất đầu.
B. Trong phản ứng thuận nghịch, các chất sản phẩm có thể phản ứng với nhau để tạo thành chất đầu.
C. Phản ứng một chiều là phản ứng luôn xảy ra không hoàn toàn.
D. Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều trái ngược nhau trong cùng điều kiện.
Lời giải:
Đáp án C.
Phản ứng thuận nghịch là phản ứng luôn xảy ra không hoàn toàn.
Vậy là các em đã tìm hiểu xong bài học về Lý thuyết và Bài tập Khái niệm về cân bằng hoá học. Mong các em sẽ học ngày càng tốt hơn nữa môn Hoá 11.