Cùng congthuctoanlyhoa khám phá Lý thuyết Tính chất hóa học và vật lý của Nhôm chi tiết, đầy đủ nhất. Bài viết cung cấp cho các em cái nhìn sâu sắc về Tính chất hoá học, tính chất vật lý, ứng dụng và cách điều chế Nhôm và cách giải các bài tập. Bài viết này sẽ hỗ trợ cho các em trong việc học tốt môn Hoá học lớp 9.
A. Lý thuyết tính chất của Nhôm
I. TÍNH CHẤT VẬT LÝ
– Nhôm là kim loại nhẹ (D = 2,7 g/cm3), màu trắng bạc, có ánh kim, nóng chảy ở 6600C
– Nhôm có tính dẫn điện, dẫn nhiệt tốt
– Nhôm có tính dẻo nên có thể cán mỏng được
II. TÍNH CHẤT HÓA HỌC
1) Nhôm phản ứng với phi kim
a) Phản ứng của nhôm với oxi
4Al + 3O2 2Al2O3
Ở điều kiện thường, nhôm phản ứng với oxi tạo thành lớp Al2O3 mỏng bền vững. Lớp oxit này bảo vệ đồ vật bằng nhôm, không cho nhôm tác dụng với oxi trong không khí và nước.
b) Phản ứng với phi kim khác
2Al + 3Cl2 2AlCl3
2Al + 3S Al2S3
2) Tác dụng với nước
– Vật bằng nhôm không tác dụng với nước kể cả khi đun nóng vì có lớp màng Al2O3 không cho nước thấm qua
– Nếu phá bỏ lớp Al2O3 thì Al tác dụng với nước
2Al + 6H2O → Al(OH)3 + 3H2
3) Nhôm phản ứng với dung dịch axit
– Nhôm phản ứng với dung dịch axit HCl và H2SO4 loãng tạo thành muối nhôm và giải phóng hiđro
2Al + 6HCl → 2AlCl3 + 3H2
– Nhôm phản ứng với dung dịch axit H2SO4 đặc, nóng và HNO3 đặc, nóng
8Al + 30HNO3đặc 8Al(NO3)3 + 3N2O + 15H2O
8Al + 15H2SO4 đặc 4Al2(SO4)3 + 3H2S + 12H2O
*Chú ý: Nhôm không tác dụng với H2SO4 đặc, nguội và HNO3 đặc, nguội
4) Nhôm phản ứng với dung dịch muối
Nhôm phản ứng với dung dịch muối của kim loại kém hoạt động hơn tạo thành muối nhôm và giải phóng kim loại trong muối
2Al + 3Cu(NO3)2 → 2Al(NO3)3 + 3Cu
5) Nhôm phản ứng với dung dịch kiềm
Do lớp oxit nhôm bị hòa tan trong kiềm nên nhôm phản ứng với dung dịch kiềm
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
6) Tác dụng với một số oxit kim loại ở nhiệt độ cao (phản ứng nhiệt nhôm)
Nhôm khử được các oxit kim loại đứng sau Al trong dãy hoạt động hóa học
2Al + Fe2O3 2Fe + Al2O3
2Al + 3CuO 3Cu + Al2O3
III. ỨNG DỤNG
– Chế tạo đồ dùng gia đình, dây dẫn điện, vật liệu xây dựng
– Chế tạo hợp kim Đuyra dùng trong công nghiệp chế tạo máy bay, ô tô
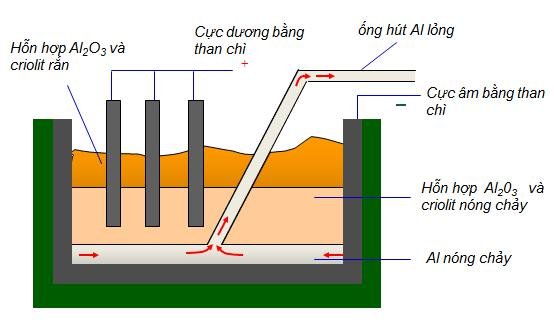
IV. ĐIỀU CHẾ
– Nguyên liệu để sản xuất nhôm là quặng bôxit có thành phần chủ yếu là Al2O3
Phương pháp: Điện phân hỗn hợp nóng chảy của nhôm oxit và criolit, thu được hỗn hợp nhôm và oxi
2Al2O3 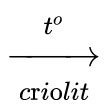
B. Bài tập tính chất của Nhôm
Bài 1: Hãy điền vào bảng những tính chất tương ứng với những ứng dụng của nhôm:
| Tính chất của nhôm | Ứng dụng của nhôm | |
| 1 | Làm dây dẫn điện | |
| 2 | Chế tạo máy bay, ô tô, xe lửa, … | |
| 3 | Làm dụng cụ gia đình: nỗi, xoong, … |
Lời giải:
| TÍNH CHẤT CỦA NHÔM | ỨNG DỤNG CỦA NHÔM | |
| 1 | Dẫn điện tốt | Làm dây dẫn điện |
| 2 | Nhẹ, bền | Chế tạo máy bay, ôtô, xe lửa,… |
| 3 | Tính dẻo, dẫn nhiệt tốt, nóng chảy ở to cao. | Làm dụng cụ gia dụng: xoong, nồi, âm,… |
Bài 2: Thả một mảnh nhôm vào các ống nghiệm chứa các dung dịch sau:
a) MgSO4.
b) CuCl2.
c) AgNO3.
d) HCl.
Cho biết hiện tượng xảy ra? Giải thích và viết phương trình hóa học.
Lời giải:
a) Không có phản ứng, vì hoạt động hóa học của Mg > Al.
b) Al tan dần, màu xanh lam của dung dịch nhạt dần, có chất rắn màu đỏ bám vào bề mặt nhôm.
2Al + 3CuCl2 → 2AlCl3 + 3Cu ↓
c) Al tan dần, có chất rắn màu xám bám ngoài Al.
Al + 3AgNO3 → Al(NO3)3 + 3Ag ↓
d) Có khí hiđro bay lên:
2Al + 6HCl → 2AlCl3 + 3H2 ↑ .
Bài 3: Có nên dùng xô, chậu, nồi nhôm để đựng vôi, nước vôi tôi hoặc vữa xây dựng không? Giải thích.
Lời giải:
Nếu dùng xô, chậu, nồi nhôm để đựng vôi, nước vôi hoặc vữa thì
Các dụng cụ này sẽ bị chóng hư vì trong vôi, nước vôi hoặc vữa đều có chứa Ca(OH)2 là một chất kiềm nên tác dụng được với Al2O3 (vỏ bọc ngoài các đồ dùng bằng nhôm), sau đó đến Al bị ăn mòn.
Phương trình phản ứng:
Al2O3 + Ca(OH)2 → Ca(AlO2)2 + H2O
2Al + Ca(OH)2 + 2H2O → Ca(AlO2)2 + 3H2 ↑ .
Bài 4: Có dung dịch muối AlCl3 lẫn tạp chất là CuCl2. Có thể dùng chất nào sau đây để làm sạch muối nhôm? Giải thích sự lựa chọn.
a) AgNO3.
b) HCl.
c) Mg.
d) Al.
e) Zn.
Lời giải:
d) Dùng Al để làm sạch muối nhôm vì:
2Al + 3CuCl2 → 2AlCl3 + 3Cu ↓
Vậy là các em đã tìm hiểu xong bài học về Lý thuyết Tính chất của Nhôm. Mong các em sẽ học ngày càng tốt hơn nữa môn Hoá học 9.