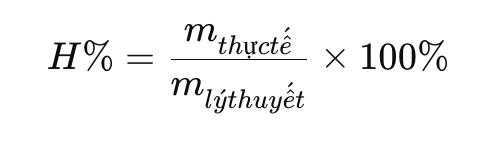Este là một trong những hợp chất hữu cơ quan trọng nhất trong chương trình Hóa học lớp 10, thuộc chương 5 – “Este và Lipit” theo SGK của Bộ Giáo dục và Đào tạo (Bộ GD&ĐT). Việc nắm vững công thức este lớp 10 không chỉ giúp bạn học chắc phần hữu cơ mà còn dễ dàng ứng dụng vào thực tế như điều chế nước hoa, chất tạo hương hay dung môi công nghiệp.
Nếu bạn đang ôn thi học kỳ hoặc chuẩn bị cho kỳ thi THPT Quốc gia, hãy cùng congthuctoanlyhoa khám phá toàn bộ lý thuyết, công thức điều chế và bài tập este lớp 10 có lời giải chi tiết trong bài viết này nhé!
1. Lý Thuyết Cơ Bản Về Este
1.1. Định nghĩa và danh pháp Este
Este là sản phẩm của phản ứng este hóa giữa axit cacboxylic (R–COOH) và ancol (R′OH), đồng thời loại bỏ một phân tử nước.
Phương trình phản ứng tổng quát:
Danh pháp theo IUPAC:
Tên este = Tên gốc hidrocacbon của ancol + Tên gốc axit (thay “ic” bằng “at”).
Ví dụ:
-
CH₃COOC₂H₅ → Etyl axetat (mùi dứa)
-
C₃H₇COOCH₃ → Metyl butirat (mùi táo)
Theo SGK Hóa 10, este đơn chức có một nhóm –COO–, còn este đa chức chứa nhiều nhóm –COO– (ví dụ: dietyl malonat).
1.2. Cấu tạo phân tử este
Nhóm chức đặc trưng của este là –COO–, trong đó nguyên tử cacbon ở nhóm cacbonyl (C=O) có lai hóa sp², tạo mặt phẳng phân tử.
So sánh nhanh:
| Hợp chất | Nhóm chức | Đặc điểm nổi bật |
|---|---|---|
| Este | –COO– | Không có H gắn với O |
| Ancol | –OH | Dễ cho proton H⁺ |
| Axit cacboxylic | –COOH | Có tính axit mạnh hơn |
1.3. Tính chất vật lý
-
Trạng thái: Thường là chất lỏng không màu, dễ bay hơi.
-
Mùi: Thơm dịu, gợi hương trái cây (chuối, dứa, táo, dâu…).
-
Độ tan: Không tan trong nước (vì không tạo liên kết hidro), nhưng tan tốt trong dung môi hữu cơ như ete hay benzen.
-
Nhiệt độ sôi: Thấp hơn axit tương ứng vì không tạo dimer.
Bảng một số este thường gặp:
| Tên este | Công thức | Mùi hương | Ứng dụng |
|---|---|---|---|
| Metyl fomat | HCOOCH₃ | Mùi trái cây | Dung môi công nghiệp |
| Etyl axetat | CH₃COOC₂H₅ | Mùi dứa | Làm nước hoa, sơn móng |
| Metyl salicylat | C₆H₄(OH)COOCH₃ | Mùi dầu gió | Thuốc xoa bóp |
2. Tính Chất Hóa Học Của Este
Mặc dù este kém hoạt động hơn axit cacboxylic, chúng vẫn tham gia một số phản ứng đặc trưng quan trọng.
2.1. Phản ứng thủy phân este
-
Trong môi trường axit:
R-COOR’ + H₂O ⇌ R-COOH + R’OH (xúc tác H₂SO₄, nhiệt).
→ Phản ứng thuận nghịch, tái tạo lại axit và ancol.
-
Trong môi trường kiềm (xà phòng hóa):
R-COOR’ + NaOH → R-COONa + R’OH.→ Phản ứng một chiều, là cơ sở điều chế xà phòng từ lipit.
Ví dụ:
CH₃COOC₂H₅ + NaOH → CH₃COONa + C₂H₅OH
2.2. Phản ứng cháy
Khi bị đốt cháy trong không khí, este tạo CO₂ và H₂O:
2.3. Một số phản ứng khác
-
Khử este bằng H₂ (xúc tác Ni) → ancol.
-
Trùng hợp este không no (ví dụ acrylat) → sản xuất nhựa, sợi tổng hợp, PVC, nilon.
Bảng tóm tắt phản ứng este lớp 10
| Loại phản ứng | Phương trình tổng quát | Điều kiện | Sản phẩm |
|---|---|---|---|
| Thủy phân axit | RCOOR′ + H₂O ⇌ RCOOH + R′OH | H₂SO₄, Δ | Axit + ancol |
| Xà phòng hóa | RCOOR′ + NaOH → RCOONa + R′OH | Δ | Muối + ancol |
| Cháy | C₄H₈O₂ + 5O₂ → 4CO₂ + 4H₂O | O₂ dư | CO₂ + H₂O |
3. Công Thức Điều Chế Este Lớp 10
Phản ứng este hóa là trọng tâm của chương trình Hóa 10.
3.1. Phản ứng este hóa tổng quát
Phản ứng thuận nghịch, hiệu suất tăng khi loại bỏ nước bằng chưng cất liên tục.
Ví dụ:
CH₃COOH + C₂H₅OH ⇌ CH₃COOC₂H₅ + H₂O
3.2. Thí nghiệm điều chế este trong phòng thí nghiệm
Dụng cụ & hóa chất:
-
Axit axetic, etanol, H₂SO₄ đặc.
-
Ống nghiệm, cốc nước nóng, ống dẫn khí.
Các bước thực hiện:
-
Cho 10 ml axit axetic và 10 ml etanol vào ống nghiệm.
-
Thêm 2–3 giọt H₂SO₄ đặc làm xúc tác.
-
Đun cách thủy khoảng 5–10 phút.
-
Ngửi mùi thơm đặc trưng của etyl axetat.
-
Tách sản phẩm bằng phương pháp chưng cất.
Lưu ý an toàn: Làm việc ở nơi thông thoáng, tránh để H₂SO₄ tiếp xúc trực tiếp với da.
4. Bài Tập Este Lớp 10 Có Lời Giải
Bài 1. Viết công thức este tạo bởi axit axetic và metanol.
Giải:
CH₃COOH + CH₃OH ⇌ CH₃COOCH₃ + H₂O → Metyl axetat.
Bài 2. Cân bằng phản ứng thủy phân propyl fomat trong môi trường kiềm.
Giải:
HCOOC₃H₇ + NaOH → HCOONa + C₃H₇OH.
Bài 3. Từ 46g etanol (M = 46) và axit axetic dư, điều chế etyl axetat với hiệu suất 80%. Tính khối lượng este thu được.
Giải:
-
n(etanol) = 46/46 = 1 mol.
-
Theo tỉ lệ 1:1, n(este lý thuyết) = 1 mol → m = 88g.
-
Hiệu suất 80% → m thực tế = 88 × 0.8 = 70,4g.
Bài 4. Viết phương trình phản ứng xà phòng hóa metyl propionat và nêu ứng dụng.
Giải:
CH₃CH₂COOCH₃ + NaOH → CH₃CH₂COONa + CH₃OH.
Ứng dụng: Dùng trong công nghiệp sản xuất xà phòng và chất tẩy rửa.
Bài 5. Nhận biết este bằng phản ứng hóa học.
Giải:
Đun este với NaOH, sau đó thêm AgNO₃ vào dung dịch sản phẩm.
→ Nếu sản phẩm có ancol metylic, sẽ không xuất hiện kết tủa Ag, vì ancol không có nhóm –CHO.
Mẹo giải nhanh bài tập este:
-
Nhớ nhóm chức –COO– để nhận dạng nhanh.
-
Cân bằng tỉ lệ mol trước khi tính toán.
-
Luôn ghi xúc tác H₂SO₄ đặc khi viết phản ứng este hóa.
-
Dùng công thức hiệu suất:
5. Kết Luận
Tóm lại, công thức este lớp 10 xoay quanh phản ứng este hóa:
Đây là phần kiến thức nền tảng, có tính ứng dụng cao trong thực tế và thường xuất hiện trong đề thi. Việc hiểu rõ cấu tạo, tính chất và cách điều chế sẽ giúp bạn nắm vững phần hữu cơ và đạt điểm cao trong các kỳ kiểm tra.
FAQ – Câu Hỏi Thường Gặp
1. Este là gì theo SGK Hóa 10?
→ Este là hợp chất hữu cơ được tạo thành từ phản ứng giữa axit và ancol, có công thức chung RCOOR′.
2. Công thức điều chế este đơn giản nhất?
→ Axit axetic + etanol ⇌ etyl axetat + nước (xúc tác H₂SO₄ đặc).
3. Phân biệt este và lipit?
→ Este là hợp chất có phân tử nhỏ, còn lipit là este của axit béo và glixerol.
4. Bài tập este thường gặp trong đề thi?
→ Viết phương trình este hóa, thủy phân, tính khối lượng sản phẩm, nhận biết este.
5. Este có độc không?
→ Hầu hết este dùng trong thực phẩm hoặc mỹ phẩm đều an toàn, tuy nhiên một số este công nghiệp có thể gây kích ứng nếu hít nhiều.