Trong Hóa học 10, Cấu hình electron của nguyên tử được xem là một trong những kiến thức căn bản cần nắm vững, nhất là trong dạng Hóa Vô Cơ. Bài viết này sẽ cung cấp cho các bạn kiến thức tổng quan nhất về thế nào là cấu hình electron, cách vẽ dễ nhớ nhất cùng các bài tập mình họa có lời giải.
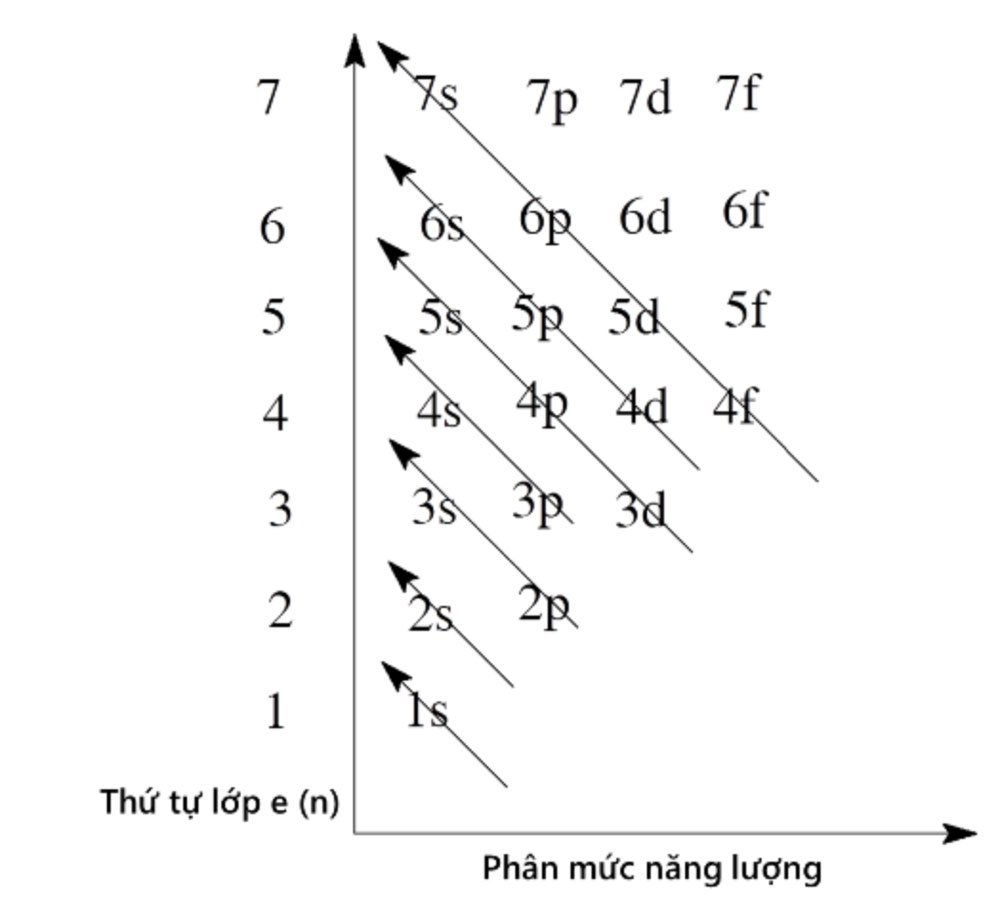
Thứ tự các mức năng lượng của nguyên tử
Các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm các mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s 3d 4p 5s…
Cấu hình electron của nguyên tử
Cấu hình electron là gì?
- Cấu hình e biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau.
Quy ước viết cấu hình electron nguyên tử
-
Số thứ tự lớp electron được viết bằng các chữ số (1, 2, 3)
-
Phân lớp được kí hiệu bằng các chữ cái thường (s, p, d, f)
-
Số electron trong phân lớp được biểu thị bằng chỉ số ở phía trên bên phải kí hiệu của phân lớp (s^2, p^6, d^10)
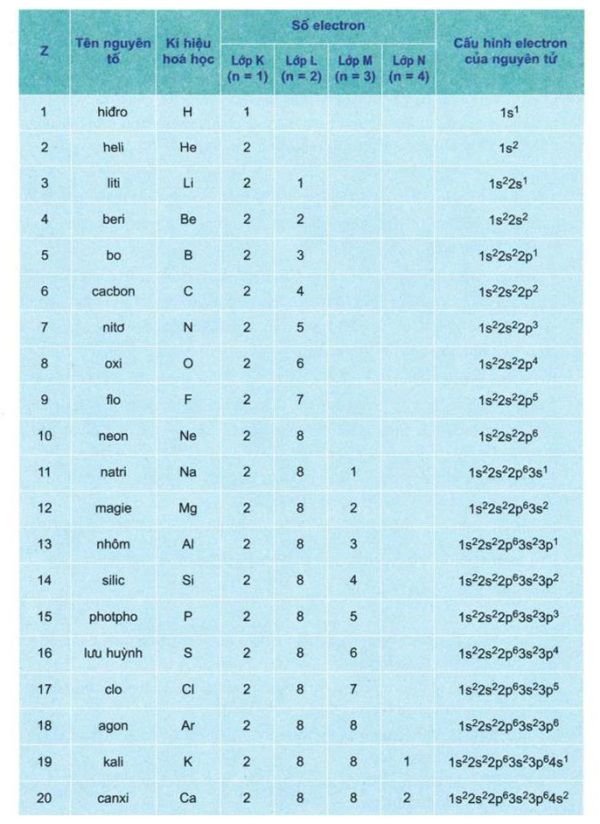
Cấu hình electron của 20 nguyên tố đầu tiên
Trong chương trình Hóa học 10, ta sẽ làm quen trước với 20 nguyên tố đầu tiên
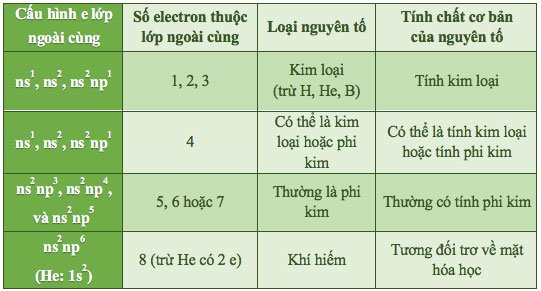
Đặc điểm các lớp electron ngoài cùng
Nguyên tử của tất cả các nguyên tố có tối đa 8 e lớp ngoài cùng
3 bước viết cấu hình electron nguyên tử dễ nhớ
Sau khi nắm được đầy đủ lý thuyết của cấu hình electron nguyên tử, sau đây là 3 bước viết cấu hình e đơn giản và dễ nhớ nhất.
-
Bước 1: Xác định số electron của nguyên tử (Z).
-
Bước 2: Sắp xếp các electron theo thứ tự tăng dần mức năng lượng theo quy tắc đã học: 1s 2s 2p 3s 3p 4s 3d 4p 5s…
-
Bước 3: Viết cấu hình e: Sắp xếp theo thứ tự từng lớp (1→7), trong mỗi lớp sắp xếp theo thứ tự từng phân lớp (s→p→d→f). Ví dụ: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s…
Một số lưu ý khi viết cấu hình electron:
-
Cần xác định đúng số e của nguyên tử hay ion (Số electron(e) = số proton(n) = Z).
-
Nắm vững các nguyên lý và quy tắc, kí hiệu của lớp và phân lớp.
-
Quy tắc bão hòa và bán bão hòa trên d và cấu hình e bền khi các e điền vào phân lớp 4 đạt bão hòa (d, f) hoặc bán bão hòa (d, f).
Ví dụ:
Viết cấu hình e nguyên tử của các nguyên tố sau: Na (Z=11):
- Bước 1: Xác định E=Z=11
- Bước 2: Sắp xếp các e theo thứ tự tăng dần: 1s² 2s² 2p^6 3s^1
- Bước 3: Viết cấu hình e: 1s² 2s² 2p^6 3s^1
Như vậy, các nguyên tố s, p, d, f được xác định như sau:
- Nguyên tố s: e cuối cùng điền vào phân lớp s.
- Nguyên tố p: e cuối cùng điền vào phân lớp p.
- Nguyên tố d: e cuối cùng điền vào phân lớp d.
- Nguyên tố f : e cuối cùng điền vào phân lớp f.
Tổng kết
Trong bài viết này, congthuctoanlyhoa.com đã tổng hợp lại định nghĩa về Cấu hình electron cùng cách vẽ dễ nhớ nhất. Chúc các bạn học sinh có thể hoàn tất bài học này dễ dàng và nắm được kiến thức nền căn bản này.